Причины появления коррозии при сварке
Появление коррозии в первую очередь на сварных соединениях, объясняется двумя причинами:
- разрывом первичных межкристаллических связей и получением новых, отличных по своим механическим свойствам от прежних, а также появление напряжений в структуре металла.
- изменением химического состава, появлением оксидов (эндогенных неметаллических включений), являющихся концентраторами напряжений в структуре;
- образованием гальванической пары за счет изменений в хим. составе сварного шва.
Влияние вышеперечисленных изменений возрастает пропорционально степени и интенсивности, количеству и размерам. Скорость протекания реакции окисления дополнительно определяется условиями работы: климатической составляющей, физико-химическим воздействием (рабочей средой).
Виды коррозии сварочного шва
На данный момент достаточно изучили, какие существуют виды коррозионного разрушения сварных соединений и в зависимости от характера их действия, к ним применяются соответствующие меры защиты.
По характеру разрушения коррозия подразделяется на 3 типа:
- Сплошная
Преобладает преимущественно в углеродистых нелегированных или мало легированных сталях с однородной структурой. Шов, вне зависимости от марки стали, всегда разрушается более интенсивно, чем целостная плоскость.
Внешний вид сплошной коррозии
- Точечная или местная
К такому виду разрушения предрасположена сталь неоднородная по своему химическому составу. Такая коррозия развивается в слабо ржавеющих сталях типа Х12МФ или в сварных швах, обедненных хромом. Обуславливается также и условиями эксплуатации.
Местная коррозия металла
- Межкристаллитная или ножевая
Наиболее опасный вид коррозии. Разрушение происходит по границам зерен металла по всей толщине. Подвержены этому «заболеванию» аустенитные (нержавеющие) стали, подвергающиеся продолжительному нагреву свыше 600 ºС, в том числе и свариванию.
Межкристаллитная коррозия металла
Гальваническая пара также способствует этому виду разрушения: сварное соединение после расплавления меняет свой химический состав и при воздействии на него электролита, в качестве которого может выступать даже вода, истощается в первую очередь. Такой вид коррозии «работает» одновременно может работать на большой площади металла, который разрушается даже при небольшой нагрузке.
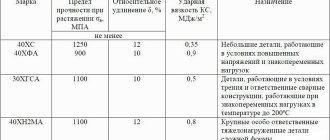
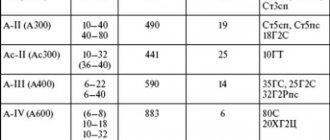
КОРРОЗИОННАЯ стойкость И ПРОЧНОСТЬ СВАРНЫХ СОЕДИНЕНИЙ
виды и ОСОБЕННОСТИ коррозионных РАЗРУШЕНИЙ СВАРНЫХ СОЕДИНЕНИЙ
Виды и особенности коррозионных разрушений металлических, в том числе сварных, конструкций определяются свойствами материала, напряженным состоянием в конструкции, свойствами коррозионной среды и условиями взаимодействия металла со средой (температурой, временем, условиями контактирования, давлением и др.). Механизм коррозионных разрушений сварных соединений не отличается от механизма разрушений основного металла. Особенности, которые определяют (в отличие от основного металла) причины, характер, кинетику и механизм разрушений сварных соединений, зависят от физико-химического воздействия сварки, вызывающего неблагоприятное изменение и неоднородность свойств металла и напряженного состояния, следствием чего является усиление отрицательного воздействия среды.
Для сварного соединения характерны: а) структурно-химическая макро — и микронеоднородность (основной металл, литой металл шва, переходные структурные зоны влияния; зерна, границы зерен, фазы включения и т. д. в пределах каждой зоны); б) неоднородность напряженного состояния собственного (остаточные напряжения и пластическая деформация) и от внешней нагрузки; в) геометрическая неоднородность (технологические и конструктивные концентраторы). Эти основные виды неоднородности определяют механическую, физическую и электрохимическую макро — и микронеоднородность сварных соединений (рис. 1) и особенности коррозионных разрушений сварных соединений (рис. 2).
По механизму различают коррозию химическую и электрохимическую. Химическая коррозия представляет собой процесс взаимодействия металла с агрессивным компонентом среды (сухими газами, неэлектролитами) по реакции Me -+- х -*■ Me х. Электрохимическая коррозия — процесс самопроизвольного разрушения металла в результате электрохимических реакций, скорость которых определяет скорость коррозии: а) анодной реакции — перехода ионов металла Ме+ в раствор с оставлением эквивалентного количества п электронов е в металле; Ме°—пе-+ МеЛ+, определяющей материальные потери при коррозии; б) катодной реакции—процесса восстановления окислительных компонентов среды D (Н+, 02, Cl2, Br2, NOJ, и др.) за счет присоединения появившихся в металле избыточных электронов (процесс деполяризации D + пе -> (Dne); в) процесса перетекания электронов по металлу и соответствующего перемещения катионов (+) и анионов (—) в растворе, т. е. коррозионного тока [1]. В подавляющем большинстве сред процесс коррозии является электрохимическим.
По виду коррозионных разрушений различают общую (сплошную) коррозию (равномерную, неравномерную, избирательную); местную (локализованную в виде язв, точек, под поверхностью, межкристаллитную); растрескивание под действием статических и циклических нагрузок.
Особенности общей электрохимической коррозии сварных соединений связаны с электрохимической неоднородностью двух видов: а) макронеоднородностью, обусловленной различием химического состава и структуры в разных зонах соединения; б) микронеоднородностью, обусловленной структурной и химической неоднородностью в пределах каждой зоны (рис. 3). Поэтому в коррозионном отношении сварное соединение представляет собой сложную многоэлектродную короткозамкнутую электрохимическую систему, характерными макро
электродами которой являются шов, зона термического влияния с серией переходных структур, основной металл (табл. 1).
Макронеоднородность оценивается по величине средних электродных потенциалов ф каждой зоны, микронеоднородиость — по величине локальных элек-
| Рис. 1. Неоднородность сварных соединений в поперечном сечении: а — максимальные температуры; 6 — схемы сварного соединения; в — твердости HV, НВ, величина ц зерна и плотность ц окисной пленки; г — механические свойства при изгибе; Р — несущая нагрузка, кгс; а — угол изгиба; д — электродный <�р и термоэлектрический Е потенциалы, мВ; е — остаточные пластические продольные еХу и поперечные Ъуу деформации; р — ориентировочная плотность дислокаций; ж — остаточные продольные аху и поперечные Оуу напряжения, кгс/мм2: 1 — СтЗсп; 2 — I2X18H10T; 3 — ВТ1-1; 4 — АМгб, 6=3 мм, аргонодугозая сварка вольфрамовым электродом |
тродных потенциалов ф; в пределах каждой зоны. Показателем макроэлектрохими — ческой неоднородности сварного соединения является разность начальных потенциалов Аф между зонами. Показателем микронеоднородности каждой зоны служит разброс начальных локальных потенциалов Аф{. = Фітах — Ф/тіпв пРеДелах каждой зоны.
Восприимчивость сварного соединения в целом или какой-либо его зоны к воздействию коррозионных сред и скорости коррозии зависит от общих и локальных электродных потенциалов и поляризуемости. Чем отрицательнее потенциалы и больше их разность, тем, как правило, больше скорость коррозии.
Рис. 2. Виды
В зависимости от значений Дф и Дф/ возможны следующие характерные случаи общей коррозии сварных соединений: а) Дф > 0, Дф/ -> 0, — коррозия но преимущественно макрогетерогенноэлектрохимическому механизму. Определение чр и Дф» позволяет в первом приближении судить о неустойчивости различных зон
Рис. 3. Схемы коррозии сварного соединения:
/ — характерное распределение начальных макропотенциалов в сварном соединении; Фш — электродный потенциал шва;
Ф3 т. в ~ электродный потенциал зоны термического влияния; фм — электродный потенциал основного металла; Фуст — установившийся стационарный потенциал заполяризованной системы шов — зона термического влияния (з. т.в.) — основной металл; II — макроэлектрохимическая коррозия, макропара основной металл — зона термического влияния, макропара зона термического влияния — шов, макропара основной металл — шов с зоной термического влияния; III — коррозия саморастворения каждой зоны: / — гетероген
ный механизм электрохимической коррозии; 2 — гомогенный механизм электрохимической коррозии; 3 — химическая коррозия и всего соединения в целом; б) Дф -> 0, Дф/ >0 — коррозия по преимущественно микроэлектрохимическому механизму; в) Дф > 0, Дф/ >0 — смешанный механизм коррозии.
Общая (сплошная) электрохимическая коррозия характерна для сварных конструкций из углеродистых и низколегированных сталей в большинстве природных сред (атмосфере, водных средах, почве).
Местные избирательные виды коррозии характерны для сварных соединений высоколегированных сталей и цветных металлов в средах, в которых металл
| I. Электродные потенциалы различных зон сварных соединений в 3%-ном NaCl Электродный потенциал, мВ | ||||
| Материал | Способ сварки | Основной металл | Сварной шов | Зона термического влияния |
| Стали низкоуглеродистые низколегированные: 09Г2С | Ручная дуговая, электрод | —460 | -540 | -480 |
| 17Г2С1 | типа Э55 | -500 | —540 | -550 |
| 17Г2СФ | -455 | -5-10 | -485 | |
| Коррозионностойкие стали: 12Х18Н10Т | Аргонодуговая | + 137 | + 108 | +75 |
| 10Х14АГ15 | Ручная без присадки, | -170 | — 163 | —250 |
| электроды ОЗЛ8 | ||||
| Алюминиевые сплавы | ||||
| АМгб | Аргонодуговая без при- | —492 | —514 | -567 |
| AM г 62 | садки | -680 | -700 | -880 |
| Технический титан | Аргонодуговая без при- | -125 | -180 | —140 |
| вты Цирконий | садки | —455 | -393 | —446 |
| Тантал | Электронно-лучевая | —180 | -240 | -212 |
| Ниобий | —241 | —255 | -280 |
находится в пассивной и пассивно-активной области. Межкристаллитная коррозия, связанная со структурными изменениями в сталях, характерна при воздействии на них нагрева до критических температур 450—900° С для аустенитных и выше 900° С для высокохромистых ферритных сталей. Примером является межкристаллитная коррозия сварных соединений аустенитных хромоникелевых сталей, подробно рассмотренная в работе [6]. Разрушение развивается в трех зонах: в основном металле, нагреваемом при сварке до 500—900° С, в сварном шве и в основном металле вблизи линии сплавления в узкой зоне, нагреваемой до температур свыше 1200—1250° С (ножевая коррозия). Преимущественное разрушение границ зерен обусловлено электрохимической неоднородностью металла, возникающей при определенных для каждого сплава температурно-временных условиях в связи с выделением избыточных фаз. Если избыточные фазы образуют протяженные цепочки по границам зерен, то коррозионное разрушение приобретает чрезвычайно опасный межкристаллитный характер. Наиболее характерными избыточными фазами коррозионно-стойких сталей, практически постоянно в них присутствующими, являются карбиды. В зависимости от химического состава стали и условий термического воздействия на них образуются карбидные фазы [2] следующих типов: МС (Мє Ті, Nb, W, Zr, Та); M2C (MeW, Mo); M3C (на основе железа); MfCgnM^Q (на основе хрома), М^М^С(M’eFe, Ni, Со, Si; M»geW, Мо, Та, V, Cr, Nb); часто п + т = 6; М12С. Наряду с карбидными возможно образование других фаз, представляющих собой соединения компонентов стали с неметаллами (нитриды, карбонитриды, сульфиды, бориды и др.), а также интер — металлидкых фаз (о, л/), ряд фаз типа Лавеса (Fe2Mo, FeaW, Fe2Nb), упрочняющих фаз [M3Ti, М3А1) и др.
Принципиальная схема влияния температурно-временных условий на выделение карбидов и межкрисгаллитную коррозию показана на рис, 4. Темпера туры 850° С благоприятны для преимущественного выделения М23Сб (кривая /). Ножевая коррозия связана с выделением цепочки карбидов стабилизирующих ■элементов (МС) под действием высоких температур (> 1200—1250° С) по границам зерен (околошовной зоны). Так как скорость коррозии (кипящая 56%-ная HN03) карбида титана примерно в 1000 раз, а карбида ниобия в 3—4 раза больше, чем скорость коррозии стали, то происходит избирательное растворение частиц карбидов, расположенных по границам зерен при катализирующем действии ■этого процесса на растворение прилегающих участков стали. Дополнительное тепловое воздействие в области критических температур (наложение второго шва) приводит к выделению карбидов хрома (М23С6), что усложняет механизм ножевой коррозии и повышает ее скорость. В окислительных средах кислотостойкие хромоникелевые стали, стабилизированные титаном, менее стойки, чем
стабилизированные ниобием, которые, в свою очередь, менее стойки, чем с низким содержанием углерода.
Межкристаллитная коррозия алюминиевых сплавов также связана с выпадением избыточных (интерметаллидных) фаз типа CuA12, Mg2Al3, MgZn2 и др.
Точечная коррозия типична для пассивирующихся металлов (хром, алюминий, хромоникелевые стали и др.) и возникает в результате повреждения в отдельных участках пассивной пленки. В сварных соединениях точечной коррозии подвержена преимущественно зона термического влияния.
Коррозионное разрушение сварных соединений
в напряженном состоянии [4]. Напряженное состояние влияет на коррозионное поведение металла вследствие: а) сообщения металлу добавочной энергии, в связи с чем иону Ме+ легче покинуть решетку деформированного металла по сравнению с неде- формированным; б) нарушения под действием деформации сплошности и защитных свойств поверхностных пленок; в) повышения степени неоднородности, связанной с появлением под действием деформаций дефектов кристаллической решетки и новых анодных фаз.
Скорость коррозии q относительно мало изменяется под влиянием упругих напряжений в нейтральных и щелочных средах, но может заметно (в 2—3 раза) увеличиваться в кислых средах пропорционально напряжениям: q = q0 — f — а о, где — скорость без растягивающих напряжений; а — коэффициент пропорциональности. Незначительно влияя на общую коррозию, напряжения интенсифицируют местные виды коррозии, наиболее опасными из которых является растрескивание, вызываемое статическими нагрузками, и коррозионная усталость при циклическом нагружении.
Коррозионное разрушение в напряженном состоянии определяется коррозионными, механическими и сорбционными процессами, а также сопутствующими процессами (кавитация, радиация). Коррозионное растрескивание состоит из двух основных периодов: а) зарождения трещины или инкубационного периода (С), в течение которого на металлической поверхности под влиянием локализации коррозионного процесса и растягивающих напряжений происходит зарождение первичных коррозионно-механических трещин; б) периода развития трещины (/р), который, в свою очередь, определяется временем докритического (субкритического) роста трещины до ее критических размеров, после чего происходит лавинообразное разрушение. Скорость субкритического роста коррозионных трещин в зависимости от материала, напряжений и среды изменяется в пределах 10—10_б мм/ч,
Постоянное разрушение пленки и интенсивное перемещение раствора при циклическом нагружении может резко повысить скорость разрушения при коррозионной усталости по сравнению с коррозионным растрескиванием.
| Рис. 5. Влияние напряжений и вида напряженного состояния на коррозионное растрескивание в различных средах (сплошные линии — сварное соединение, штриховые — основной металл): |
а — овн > 0, <�т0СТ — 0; 1,4 — одноосный изгиб: 2 — двухосный изгиб, 3, 5, 6 — одноосное растяжение; 1, 2, 3 — 12Х18Н10Т; 4 — ОТ4; 5 — СтЗсп; 6 — АМгб; б — (Тост Овн = 0; / — 12Х18Н10Т; 2 — ВТ1-1; 3 — СтЗсп; 4 — ОТ4; в — Ови > О, (Тост > 0; 1 — 12 XI8Н ЮТ; 2 — ОТ4; среды —- см. табл. 3
Разрушения вызываются растягивающими напряжениями. Для большинства сочетаний металл—среда имеются пороговые значения напряжений апор, ниже которых растрескивание не имеет места вообще или на определенной базе испытаний (рис. 5). Пороговые напряжения варьируются в пределах (0,2—1)ат (табл. 2). Сварные соединения растрескиваются интенсивнее по сравнению с основным металлом в связи с воздействием сварочного процесса. Остаточные сварочные напря-
2. Ориентировочные значения отношения пороговых напряжений к пределу текучести некоторых материалов в характерных средах, вызывающих их растрескивание
| ДЛатериал | Среда | Темпера тура, °С | Основной металл | Сварные соедине ния |
| Углеродистые и низколегированные стали | Щелочные растворы Растворы нитратов Среды с сероводородом | Т > 60 °С Кипение Нормальная | 0.9—1 0.5 0,5—1 | 0,9-1 0,5 0,3—0,5 |
| Коррозионно-стойкие хромоникелевые стали типа 12X18 ШОТ: отожженные деформированные | Хлориды | Кипение | 0,5—0,6 0,2—0,5 | оо 1 1 ЧГ ся 0*0 |
| Алюминиевые сплавы | Растворы на основе 3%-ного NaCI | Нормаль ная | 0,6 | 0.5 |
| Титановые а-сплавы | Бромисто-метаноловые | 0.5 | ОД—0,4 |
жения без внешней нагрузки могут вызывать интенсивное растрескивание (рис. 5, 6). В средах, вызывающих растрескивание, действие остаточных напряжений и напряжений от внешней нагрузки суммируется (рис. 5, в).
Влияние пластической деформации на коррозионное разрушение не однозначно (рис. 6), так как в результате пластической деформации могут возникать как благоприятные, так и неблагоприятные изменения свойств металла и напряженного состояния. К неблагоприятным относятся: а) повышение внутренней энергии металла; б) возникновение при деформации анодных фаз, дефектов се — шетки, микро — и макронарушений поверхности и структуры, сопровождающихся
Рис. 6. Влияние предварительной пластической деформации растяжением на время до коррозионного растрескивания стали СтЗсп (1), 12Х18Н10Т (2), сплава АМгб (5) и деформации сжатием сплава АМгб (4). Коррозионные испытания при постоянной нагрузке о = 0,9от
увеличением и концентрацией напряженности II рода; в) возникновение при неравномерной пластической деформации собственных растягивающих напряжений I рода. Процессами, способствующими повышению стойкости, являются:
а) уменьшение, перераспределение и снятие в процессе деформации собственных напряжений I рода, а также возникновение сжимающих напряжений на поверхности; б) более равномерное распределение анодных участков, что уменьшает локализацию коррозионного разрушения. В зависимости от металла и среды, деформационно-силовой схемы, степени деформации и термодеформационных условий превалируют те или иные процессы и имеет место увеличение или уменьшение стойкости металла. Отрицательное влияние концентраторов особенно резко проявляется в средах, в которых металл находится в пассивном или активно-пассивном состоянии. С увеличением агрессивности сред влияние концентратора ослабевает. Чем выше уровень напряженности, тем сильнее проявляется влияние концентраторов при относительно меньшем влиянии среды.