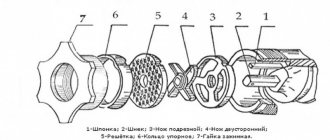
Следует подчеркнуть, что стойкость алюминия и алюминиевых сплавов к нормальным условиях окружающей среды является очень высокой. Главным источником защиты от коррозии является прочная, самовосстанавливающаяся оксидная пленка, которая всегда присутствует на алюминии в условиях окружающей воздушной атмосферы (рисунок 1).
Рисунок 1 – Естественная защита алюминия от коррозии – поверхностная оксидная пленка [4]
Основные типы коррозии алюминия
Для коррозии алюминия характерны следующие основные типы [4]:
- Общая коррозия
- Щелевая коррозия
- Фреттиниг-коррозия
- Коррозия под напряжением
- Гальваническая коррозия
- Точечная (питтинговая) коррозия
- Межзеренная коррозия
- Подповерхностная коррозия
Рисунок 2 – Общая коррозия алюминия: растворение естественной оксидной пленки растворами сильных щелочей и некоторых кислот [4]
Рисунок 3 – Щелевая коррозия алюминия [4]
Рисунок 4 – Фреттинг-коррозия алюминия: взаимное трение двух алюминиевых компонентов в условиях шероховатого контакта [4]
Рисунок 5 – Коррозия алюминиевых сплавов под напряжением: при некоторых условиях в сплавах Al-Cu, Al-Mg, Al-Zn-Mg [4]
Рисунок 6 – Гальваническая коррозия алюминиевого сплава происходит в условиях его мокрого или влажного контакта с другим, более “благородным” металлом, таким как медь [4]
Рисунок 7 – Питтинговая (точечная) коррозия алюминия под воздействием хлоридных ионов [4]
Рисунок 8 – Межзеренная коррозия и подповерхностная коррозия [4]
В зависимости от условий окружающей среды, нагружения и функционального назначения детали любой из видов коррозии может явиться причиной преждевременного разрушения. Кроме того, неправильное применение алюминиевых деталей и изделий может усугублять коррозионные процессы.
Материалы, которые нельзя сочетать при гальванизации
Главная Статьи Материалы, которые нельзя сочетать при гальванизации
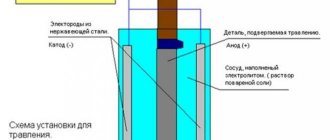
Если железо, методом горячего погружения, покрыть цинком, то получим так называемую гальванизированную сталь. Вступив в химическую связь с металлом, цинк образует антикоррозийное покрытие. Между чистым цинком, образующим верхний слой покрытия, и самим железом, прослаивается оксид цинка. Содержание оксида цинка в процентном соотношении плавно переходит от цинка к железу.
Гальваническая коррозия возникает в тех случаях, когда разные металлы соприкасаются друг с другом в присутствии электролита. Так, например, морская вода, проникающая на лодке повсюду, является отличным электролитом. Рассмотрим электрические потенциалы металлов, которые чаще всего применяются в малом судостроении, с помощью гальванической шкалы, представленной ниже.
Однако не будем углубляться в дебри химии, а для понятия практического смысла, рассмотрим основные детали:
- Из двух металлов, контактирующих между собой, тот, что находится слева, будет подвергаться коррозии.
- В зависимости от следующего условия, безопасной считается разница потенциалов в 0,1 Вольт, а разница в 0,2 Вольта считается приемлемой.
- В зависимости от открытой площади поверхности металлов, коррозия распространяется различными темпами. Лучше, если крепеж изготовлен из более благородного металла, чем само изделие, в таком случае срок его службы будет дольше. В противном случае, он очень скоро начнет подвергаться коррозии.
Если использовать алюминиевые крепежи, то вполне вероятно возникновение проблем, лучше всего использовать монелиевые заклепки, сплав которого состоит из никеля с содержанием меди, железа и марганца.
Используя данные приведенной ниже таблицы, можно самостоятельно решить, для крепления каких деталей, крепежи из какого металла лучше всего использовать. Так, например, детали из нержавеющей стали и алюминия не стоит крепить заклепками из цинка, а крепежи из латуни недопустимы для крепления изделий из бронзы.
| Крепёж | ||
| Материал детали | Допустимо | Недопустимо |
| Оцинкованная сталь | Оцинкованная или нержавеющая | Латунь и бронза |
| Алюминий | Нержавеющая | Оцинкованный, латунь |
| Латунь | Латунь или бронза | Нержавеющая |
| Бронза | Бронза или нержавеющая | Латунь |
| Нержавеющая сталь | Нержавеющая или монель | Оцинкованная или латунь |
Присутствуют сплавы, являющиеся гальваническими парами сами по себе. Примером гальванической пары может служить латунь, соприкасаясь с электролитом, одна из фаз у неё начинает корродировать. Такое свойство называется децинкификацией. Предмет из латуни, который подвергся такому взаимодействию, теряет прочность и очень неприятно выглядит.
Сталь и оцинковка
На борту лодки не стоит иметь предметы из низкоуглеродистой стали, не имеющей защитного покрытия, так как она склонна к коррозии. Если такие изделия покрыты защитным материалом, то их присутствие в лодке вполне допустимо. Достичь этого получается обычно путем нанесения слоя цинка, при этом получается 2 плюса. Цинк отлично справляется с коррозией, а в случае, если присутствует электролит, цинк подвергается коррозии раньше стали.
Известно несколько способов нанесения цинкового слоя, принципиальная разница между которыми заключается в величине толщины формируемого слоя. Для получения срока службы, приемлемого в морской среде, толщина защитного слоя должна быть около 100 мкм. Такой результат, до 125мкм, при горячем погружении, достигается лужением, результат до 40мкм достигается при окраске. Электрогальваника в таком случае не используется, с помощью нее можно достичь покрытия толщиной лишь 20 мкм.
Таким образом, блестящие оцинкованные крепежи, продаваемые в хозяйственных магазинах, могут пригодится лишь при строительстве теплицы, но никак не на лодке, где срок службы его окажется недолговечной. «Морской» крепеж просто обязан быть луженым.
Медь
При строительстве конструкций из дерева, традиционно применяют гвозди, изготовленные из медного материала с шайбами. Такие гвозди являются идеальным материалом для крепления достаточно гибких сооружений. Они устойчивы к коррозии, легко крепятся и являются достаточно гибкими для обеспечения подвижки элементов. Такие корабельные гвозди из меди до сих пор встречаются в продаже, несмотря на появление конструкций из клееных материалов и стеклопластика. Однако замечено снижение выбора таких гвоздей, так, например, пяти-шестимиллиметровые шайбы в продаже уже не найти, в связи с чем строители каноэ вынуждены заниматься расклепкой гвоздей. Исчезают с прилавков и гвозди нестандартных размеров, так необходимые при ремонте обшивки.
Латунь
Латунь традиционно применяется в роли шурупов. Вспоминая о присутствии такой проблемы, как децинкификация, крепежи из латунного материала рекомендуется применять только в защищенных местах, например, внутренняя обстройка или местах, в которых наша жизнь от него не зависит.
Бронза
Кремниевая бронза является стандартным материалом для изготовления крепежей. Используется она при изготовлении гвоздей, болтов, а также шурупов гигантских размеров. Бронза достаточно устойчива к подвержению коррозии и обладает длительным сроком службы (от 30 до 50 лет). Благодаря чему, независимо от дороговизны, крепеж из бронзы достаточно конкурентоспособен.
| Виды медных сплавов и химический состав | ||||
| Наименование | Обозначение | Состав | Применение | |
| Латуни | Обычная латунь | CZ108 | Zn 37% | Внутреннее оборудование |
| Морская латунь | CZ112 | Zn 37%; Sn 1% | Оборудование довоенных лодок | |
| Высокопрочная латунь | CZ114 | Zn 37%; Mn 2%; Al,5%; Fe 1%; Pb 1,5%; Sn 0,8%. | Такелажные скобы, гребные винты, лебёдки | |
| Коррозионностойкая латунь | CZ132 | Zn 36%; Pb 2,8%; As 0,1% | Водозапорная и трубная арматура | |
| Бронзы | Алюминивая бронза | CA104 | Al 10%; Ni 5%; Fe 5% | Высокопрочное оборудование |
| Фосфористая бронза | PB102 | Sn 5%; P 0,2% | Сборное и кованное оборудование | |
| Кремнистая бронза | CS101 | Si 3%; Mn 1% | Крепёж | |
| Оружейная бронза | LG2 | Sn 5%; Pb 5%; Zn 5% | Литьё | |
| Алюминевая бронза для литья | AB2 | Al 10%; Ni 5%; Fe 3% | Леерное и мачтовое оборудование | |
| Al — алюминий, As — мышьяк, Fe — железо, Mn — марганец, Ni — никель, P — фосфор, Pb — свинец, Si — кремний, Sn — олово, Zn — цинк. | ||||
Нежелательно и даже недопустимо создание гальванических пар из алюминия и алюминиевых сплавов в сочетании: с медью и медными сплавами, палладием, серебром, никелем, золотом, хромом, платиной, оловом и родием.
Сплавы из цинка не сочетаются:
- с серебром,
- палладием,
- родием,
- золотом,
- медью и медными сплавами,
- платиной.
Недопустимо сочетание хрома и никеля со следующими металлами:
- медь и медные сплавы,
- палладий,
- родий,
- золото,
- серебро
- и платина.
Нелегированная сталь кадмий, олово и свинец не сочетают:
- с серебром,
- родием,
- платиной,
- палладием,
- золотом.
Сплавы из магния и алюминия не допустимы:
- с золотом,
- хромом,
- серебром,
- свинцом,
- платиной,
- палладием,
- медью,
- родием
- и с легированной и нелегированной сталью.
Свяжитесь с нами любым удобным способом, для получения консультации на любой вид услуги по гальваническому покрытию.
Тел: Email Часы работы: Пн-Пт с 900 до 1800
Наши специалисты помогут вам с выбором вида и метода гальванического покрытия.
сделать заказ.
Гальваническая коррозия алюминия
Наиболее частые ошибки проектирования алюминиевых конструкций связаны с гальванической коррозией. Гальваническая или электрохимическая коррозия происходит, когда два разнородных металла образуют электрическую цепь, замыкаемую жидким или пленочным электролитом или коррозионной средой. В этих условиях разность потенциалов между разнородными металлами создает электрический ток, проходящий через электролит, который (ток) и приводит к коррозии в первую очередь анода или менее благородного металла из этой пары.
Сущность гальванической коррозии
Когда два различных металла находятся в прямом контакте с электропроводящей жидкостью, то опыт показывает, что один из них может корродировать, то есть подвергаться коррозии. Это называют гальванической коррозией.
Другой металл не будет корродировать, наоборот, он будет защищен от этого вида коррозии.
Этот вид коррозии отличается от тех видов коррозии, которые могли бы возникнуть, если бы оба эти металлы были помещены раздельно в ту же самую жидкость. Гальваническая коррозия может случиться с любым металлом, как только два различных металла будут находиться в контакте в электропроводящей жидкости.
Внешний вид гальванической коррозии
Внешний вид гальванической коррозии является очень характерным. Эта коррозия не раскидывается по всей поверхности изделия, как это бывает с точечной – питтинговой – коррозий. Гальваническая коррозия плотно локализована в зоне контакта алюминия с другим металлом. Коррозионное воздействие на алюминий имеет равномерный характер, он развивается в глубь в виде кратеров, которые имеют более или менее округлую форму [3[.
Все алюминиевые сплавы подвергаются идентичной гальванической коррозии [3].
Как защитить конструкцию или узел от контактной коррозии?
Если по конструктивным соображениям невозможно избежать нежелательного контакта разнородных металлов, то можно попытаться уменьшить гальваническую коррозию с помощью следующих методов:
- окраска поверхностей в районе их стыка;
- нанесение совместимых металлических покрытий;
- изоляция соединения от внешней среды;
- электрическая изоляция;
- установка неметаллических прокладок, вставок, шайб в болтовых соединениях.
Практика показывает, что в тех случаях, когда пренебрегают требованиями к допустимости контактов разных металлов, приходится дорого за это расплачиваться. Неправильная компоновка контактных пар выводит из строя узлы крепления, металлоконструкции и может стоять человеческой жизни.
Отзывы могут оставлять только зарегистрированные пользователи. Пожалуйста, зарегистрируйтесь
Процесс коррозии алюминия и алюминиевых сплавов зависит от многих факторов: условий окружающей среды, а также электрохимических и металлургических свойств компонентов сплава.
Принцип батареи
Гальваническая коррозия работает как батарея, которая состоит из двух электродов:
- катода, где происходит реакция восстановления
- анода, где происходит реакция окисления.
Эти два электрода погружены в проводящую жидкость, которая называется электролитом. Электролит – это обычно разбавленный кислотный раствор, например, серной кислоты, или соляной раствор, например, сульфат меди. Эти два электрода соединены снаружи электрической цепью, которая обеспечивает циркуляцию электронов. Внутри жидкости передача электрического тока происходит путем перемещения ионов. Жидкость, таким образом, обеспечивает ионное электрическое соединение (рисунок 9).
Рисунок 9 – Принцип гальванической ячейки [3]
Рисунок 1 показывает ячейку, в которой электролитом является раствор серной кислоты. Серная кислота полностью диссоциирована в воде (поскольку является сильной кислотой) путем образования ионов Н+, которые определяют кислотность среды. Происходит следующая электрохимическая реакция [3]:
- цинковый анод окисляется:
Zn → Zn2+ + 2e−
на медном катоде восстанавливаются протоны Н+:
2Н+ + 2e− → Н2
Полная реакция имеет вид:
Zn + H2O → Zn(OH)2 + H2
Эта ячейка производит электричество за счет потребления цинка, который выделяется в виде гидроксида цинка Zn(OH)2.
Для работы ячейки необходимо одновременное выполнение трех условий:
- два различных металла, которые образуют два электрода;
- присутствие электролита;
- непрерывность всей электрической цепочки.
Если хотя бы одно из этих условий не выполняется, например, если нарушается электрический контакт, то ячейка не будет производить электричество, и окисления на аноде не будет происходить (также как и восстановления на катоде).
Электрохимическая коррозия
Предыдущая43Следующая
Электрохимическая коррозия – разрушение металлов в среде электролита.
Детали многих металлических конструкций работают в среде электролита: опоры мостов, водный транспорт, паровые котлы, химическая аппаратура, водопроводные трубы, кузова автомобилей. В сырую погоду, при суточных колебаниях темпертур на поверхности металлов конденсируется пленка воды, в которой растворяются газы из загрязненной атмосферы (СO2, SO2, NO2, H2S, и др.) и образуется электролит.
Поверхность металлов неоднородна. На поверхности металла имеются дефекты кристаллической решетки, примеси других металлов, включения соединений с неметаллами и интерметаллические соединения, продукты взаимодействия с окружающей средой (оксиды, гидроксиды, соли, грязь), неровности поверхности. Эти участки поверхности металла в растворе электролита будут иметь другой, отличный от основного металла потенциал. Таким образом, на поверхности металлов создается система локальных, короткозамкнутых через металл гальванических элементов. Работа этих микроскопических элементов сопровождается коррозионным разрушением металла.
В качестве примера рассмотрим модель гальвано-пары железо-медь в кислой и нейтральной средах. В гальванопаре Fe/Cu более активным является железо, стандартный потенциал которого –0,44 В, а у меди +0,34 В. В кислой среде на аноде будет проходить реакция окисления железа:
Fe0 –2ē → Fe2+.
Ионы железа – Fe2+ – будут переходить в раствор, электроны – на медь, заряжая ее отрицательно. На поверхности меди ионы Н+ из раствора восстанавливаются (водородная деполяризация):
2H+ +2ē → H2.
Суммарная окислительно-восстановительная реакция коррозии железа:
Fe0 + 2H+ → Fe2+ + H2.
В нейтральных и щелочных растворах на катодных участках поверхности металла происходит процесс восстановления растворенного в воде кислорода (кислородная деполяризация):
O2 + 2H2O +4ē → 4OH–.
Суммарная реакция коррозионного процесса:
2Fe0 + O2 + 2H2O → 2Fe2+ + 4OH–, Fe2+ + 2OH– → Fe(OH)2.
В результате коррозии образуется Fe(OH)2, который дальше окисляется атмосферным кислородом воздуха до Fe(OH)3, окончательный продукт окисления – гидратированный оксид железа (III) (ржавчина):
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3 → 4FeOOH + 4H2O.
Рис. 9.4. Схема коррозии в кислой среде при контакте с менее активным металлом.
Гальванические пары возникают также при контакте металла с его химическими соединениями. Например, при коррозии стали анодом является зерна железа, катодом – карбид железа Fe3C (рис. 9.5).
Рис. 9.5.
Схема образования коррозионных гальванических микроэлементов в углеродистой стали, находящейся во влажном воздухе
Разность потенциалов может возникнуть вследствие различной концентрации растворенного кислорода. Раствор на поверхности металла и на участках, куда затруднен доступ кислорода, вследствие конструкционных особенностей деталей, содержит разное количество растворенного кислорода, что ведет к возникновению разности потенциалов на этих участках деталей.
В промышленных центрах атмосфера содержит загрязняющие газы: SO2, NO2, CO2, H2S и др., которые растворяясь в воде, дают кислоты, агрессивные по отношению к металлам. В кислой среде на железе будет протекать процесс коррзии с водородной деполяризацией. О влиянии состава атмосферного воздуха на скорость коррозии можно судить по следующим данным: в сельской местности скорость коррозии стали составляет 100-250, в промышленных городах 450-550 г/м2 в год.
В нейтральной среде (при достаточно чистой атмосфере) коррозия протекает с кислородной деполяризацией. Почему же скорость коррозии, прокающей с кислородной поляризацией ниже?
Для того чтобы коррозия имела место необходимо условие – электродный потенциал металла должен быть отрицательнее потенциала окислителя (деполяризатора)
Таблица 9.1
Зависимость потенциала газовых электродов от рН
| pН раствора | Е (2Н+/Н2,Pt), В | Окисляющиеся металлы | Е (О2/2ОН–), В | Окисляющиеся металлы |
| 0,0 | Pb | 1,23 | Hg | |
| –0,414 | Fe | 0,815 | Аg | |
| –0,828 | Щелочные и щ-зем., Zn, Al | 0,401 | Cu |
Как следует из данных приведенных в таблице, большинство металлов могут подвергаться коррозии с кислородной деполяризацией, но процесс этот медленный, т.к. кислород малорастворим в воде, и скорость его подвода к металлу невелика. Поступающий к поверхности металла кислород практически весь сразу же восстанавливается. При этом на поверхности некоторых металлов может образоваться защитная оксидная пленка, некоторые металлы при определенных условиях могут вообще переходить в пассивное состояние.
Предыдущая43Следующая
Дата добавления: 2017-11-21; ;
Условия для гальванической коррозии
Гальваническая коррозия основана на том же самом принципе и для того, чтобы она происходила необходимо одновременное выполнение следующих трех условий [3]:
- различные типы металлов;
- присутствие электролита;
- электрический контакт между двумя металлами.
Различные типы металлов
Для любых металлов, которые относятся к различным их типам, гальваническая коррозия является возможной. Металл с электроотрицательным потенциалом (или более электроотрицательный металл, если они оба электроотрицательные) действует как анод.
Тенденцию различных металлов образовывать гальванические пары и направленность электрохимического действия в различных коррозионных средах (морской воде, тропическом климате, промышленной атмосфере и т.д.) показывают в так называемых гальванических рядах. Чем далее удалены друг от друга металлы в этих рядах, тем более серьезной может быть электрохимическая коррозия. В разных коррозионных средах эти последовательности металлов могут быть разными (рисунок 10).
Присутствие электролита
Область контакта должна быть смочена водным раствором, чтобы обеспечивать ионную электропроводимость. В противном случае отсутствует возможность для гальванической коррозии.
Электрический контакт между металлами
Электрический контакт между металлами может происходить или путем прямого контакта между двумя металлами, или через крепежное соединение, например, болт.
Рисунок 10 [1]
Как видно из графиков рисунка 10 алюминий и его сплавы становятся анодами в гальванических ячейках с большинством металлов, и алюминий корродирует, как говорят, жертвенно и защищает от коррозии другой металл гальванической пары.
Только магний и цинк, включая и оцинкованную сталь, являются более анодными и поэтому, сами подвергаясь коррозии, защищают от нее алюминий.
Алюминий и кадмий вообще имеют почти одинаковые электродные потенциалы и поэтому ни алюминий, ни кадмий не подвергаются гальванической коррозии. К сожалению, кадмий признан весьма токсичным и все реже применяется, а во многих странах просто запрещен, как антикоррозионная защита.
Атмосферная коррозия меди
В атмосферных условиях медь отличается высокой коррозионной стойкостью. На сухом воздухе поверхность меди почти не меняется. А при контакте с влажным воздухом образуется нерастворимая пленка, состоящая с продуктов коррозии меди типа CuCO3•Cu(OH)2.
В зависимости от состава среды и еще многих факторов на медной поверхности в атмосфере сначала образуется очень тонкая защитная пленка, состоящая с оксидов меди и ее чистой закиси. Время образования этой пленки может достигать нескольких лет. Поверхность немного темнеет, становится коричневатой. Иногда пленка может быть почти черного цвета (во многом зависит от состава коррозионной среды). После образования оксидного слоя на поверхности начинают скапливаться соли меди, имеющие зеленоватый оттенок. Образующийся оксид меди и соли называют еще патиной. Цвет патины колеблется от светло коричневого, до черного и зеленого. Зависит от качества обработки поверхности, состава самого металла и среды, времени контакта с коррозионной средой (от внутренних и внешних факторов). Закись меди – красно-коричневого цвета, окись – черного. Голубые, зеленые, синие и другие оттенки патины обуславливаются различными медными минералами (сульфаты, карбонаты, хлориды и др.). Патина по отношению к основному металлу нейтральна, т.е. не оказывает на медь вредного влияния (кроме хлористой меди). Соли и оксиды, формирующие патину, нерастворимы в воде и обладают естественными декоративными, защитными свойствами по отношению к поверхности меди.
Присутствие во влажном воздухе углекислого газа приводит к образованию на поверхности смеси, которую еще называют малахитом. Сульфиды, хлориды, находящиеся в воздухе, разрушают малахит. Это ускоряет атмосферную коррозию меди.
Гальванические пары
Относительное расположение двух металлов или сплавов в гальваническом ряду указывает только возможность гальванической коррозии, если различие их гальванических потенциалов является достаточно большим. Больше этот ряд ничего не говорит, и особенно ничего – о скорости или интенсивности гальванической коррозии. Она может быть нулевой или несущественной или даже незаметной. Ее интенсивность зависит от типов металлов, которые входят в контакт – гальванической пары.
Пара: алюминий – нелегированная сталь
В строительных конструкциях алюминиевые детали, которые открыты для воздействия климатических и погодных воздействий, могут соединяться винтами из обычной стали. Опыт показывает, что алюминий в контакте со стальными винтами подвергается только очень поверхностной коррозии. Возникающая ржавчина, которая не оказывает никакого влияния на алюминий, полностью пропитывает слой оксида алюминия и образует на поверхности пятна. Фактически, для алюминиевой конструкции в контакте с незащищенной сталью важнее будет ее влияние на внешний вид и декоративные качества, а не способность сопротивляться коррозии.
Это явление имеет следующее объяснение:
- на поверхностях контакта образуются пленки с продуктами коррозии – ржавчины на стали и оксида алюминия на алюминии, которые и замедляют электрохимические реакции.
Пара: алюминий – оцинкованная сталь
Судя по гальваническому ряду, цинк является более электроотрицательным, чем алюминий. Крепеж из оцинкованной стали может, поэтому, применяться для соединения и сборки конструкций из алюминиевых сплавов. Надо помнить, что когда цинковое покрытие станет слишком изношенным, чтобы защищать сталь и алюминий, наступает предыдущий сценарий контакта между алюминием и голой сталью [3] .
Пара: алюминий – нержавеющая сталь
Хотя и существует большая разность потенциалов между нержавеющей сталью и алюминиевыми сплавами – около 650 мВ, очень редко можно увидеть гальваническую коррозию на алюминии в контакте с нержавеющей сталью. Поэтому алюминиевые конструкции очень часто собираются с применением болтов и винтов из нержавеющей стали [3].
Пара: алюминий – медь
Контакт между алюминиевыми сплавами и медью, а также медными сплавами (бронза, латунь) приводит к совершенно незначительной гальванической коррозии алюминия под воздействием атмосферных условий. Тем не менее, рекомендуется обеспечивать электрическую изоляцию между этими двумя металлами, чтобы локализовать коррозию алюминия.
Необходимо отметить, что продуктом коррозии меди является, так называемая, патина. Эта патина – голубовато-зеленый налет на меди, который состоит в основном из карбоната меди. Эта патина химически воздействует на алюминий и может восстанавливаться с образованием малых частиц меди. Эти медные частицы, в свою очередь, могут вызывать локальную питтинговую коррозию алюминия [3].
Электрохимическая коррозия (гальваническая пара медесодержащих и алюмосодержащих мате
Алюминиевые радиаторы и медные трубы.
Наличие медных труб в системе отопления на основе алюминиевых радиаторов не представляет никаких проблем, что может быть подтверждено на основе более чем тридцатилетнего опыта работы с установками данного типа. В действительности, при вхождении двух различных металлов или металлических сплавов в контакт при помощи электролита, один из двух металлов может быть подвержен электрохимической коррозии (эффект батареи).
Электрохимическая коррозия проявляется только при одновременном соблюдении трех следующих условий: — металлы различной природы — наличие электролита — электрическая непрерывность между двумя металлами Влияние электролита является важным, если он характеризуется повышенным содержанием солей, что может иметь место в отопительной системе, если химико-физические характеристики воды для заполнения не соответствуют характеристикам, необходимым для нормальной работы системы, или были изменены после (см использование солей для контроля жесткости).
Электрическая непрерывность должна проходить через клапаны (латунь, сталь), соединения (сталь) и вкладыши (изолирующий материал), что крайне мало вероятно при профессиональном проведении установки в соответствии с действующими нормами. Кроме того, алюминий — это металл, подверженный естественному окислению, т.е. в естественных условиях на его поверхности образуется защитный окисленный слой, что также гарантируется возможным наличием металлических частиц в воде системы.
Только истончение данного защитного слоя может понизить сопротивление изделия, истончение, которое может проявиться при агрессивных характеристиках воды. Исходя из многолетнего опыта, приобретенного в ходе работы с данными системами, мы можем гарантировать полную безопасность и совместимость медных труб и алюминиевых радиаторов. Это взято с Действительно, если в закрытом отопительном контуре при варианте незначительной подпитки, обеспечить стабильный водно-химический состав теплоносителя с минимальным содержанием солей жёсткости (дистиллированная вода или ионообменное умягчение), то эта сторона проблемы теряет свою актуальность. А прочие проблемы, затронутые в начале поста, решаются различными вариантами механических разделителей на границе возможных контактов. Спасибо Всем за активное участие.
Как избежать гальванической коррозии
- Выбирать в пару алюминию или его сплаву металл, который как можно более ближе к нему в гальваническом ряду для рассматриваемой коррозионной среды (см. рисунок 10).
- Применять «катодный» крепеж. Избегать комбинаций с неблагоприятным (большим) отношением площадей катода к аноду (рисунок 3).
- Обеспечивать полную электрическую изоляцию двух соединяемых металлов. Это может быть выполнено с помощью изолирующих прокладок, втулок, шайб и т.п. (рисунок 12).
- Если применяется окраска, всегда нужно красить катод. Если покрасить только анод, любая царапина на нем даст неблагоприятное отношение поверхностей катода к аноду и приведет к коррозии царапины.
- Увеличивать толщину анода или устанавливать в соединение заменяемые массивные прокладки из анодного металла.
- По возможности размещать гальванический контакт вне коррозионной среды.
- Избегать резьбовых соединений из металлов, образующих гальваническую пару. Заменять их паяными или сварными соединениями.
- Если возможно, применять ингибиторы коррозии, например, в системах с циркуляцией жидкости, которая может играть роль электролита для гальванической коррозии.
- В случаях, когда металлы должны оставаться в электрическом контакте через наружную электрическую цепь, нужно разнести их как можно дальше друг от друга для увеличения сопротивления жидкой цепи (электролита).
- При необходимости и там, где это возможно, применять катодную защиту с цинковым или магниевым жертвенными анодами.
- В наиболее агрессивных средах только цинк, кадмий и магний могут быть в контакте с алюминием без возникновения гальванической коррозии. Заметим, что применение кадмиевых покрытий в значительной степени ограничено из-за их экологической небезопасности.
Рисунок 11 [1]
Рисунок 12 [1]
Источники:
- TALAT 5104.
- Corrosion of Aluminum and Aluminum Alloys. Edited by J.R. Davis. – ASM International, 1999.
- Corrosion of Aluminium / Christian Vargel – ELSEVIER, 2004
- TALAT 1252