Коррозия металла — что это: виды и способы борьбы
«Коррозия» — термин, который известен нам как процесс самопроизвольного разрушения металла.
Ежегодно миллионы тонн металла под воздействием физико-химических и химических реакций, возникающих во время взаимодействия с окружающей средой, «съедаются» коррозией. Развитие саморазрушения может быть как частичным (местная коррозия), так и полным (сплошная коррозия), а все зависит от длительности и интенсивности разрушающего процесса. По типу коррозия подразделяется на химическую и электрохимическую.
Химическая коррозия обусловлена взаимодействием поверхности металлических материалов с коррозионно-активной средой. Данный процесс разрушения металла протекает в жидкостях и газах, которые, в свою очередь, не в состоянии проводить электрический ток. Из этого следует, что химическое саморазрушение подразделяется на газовую коррозию, где разрушение происходит именно под воздействием газов при высоких температурах, и коррозию в жидких неэлектролитах, которые бывают органического (нефть, бензин, керосин, различные спирты и т. п.) и неорганического происхождения (расплавленная сера, жидкий бром и т. п.).
Электрохимическая коррозия подразумевает собой разрушение металла при непосредственном контакте с электролитически проводящей окружающей средой. Для такого вида коррозии всегда требуется наличие электролита, с которым соприкасаются электроды. Также это могут быть два разных металла с разными окислительно-восстановительными свойствами, соприкасающиеся друг с другом и образующие гальваническую пару.
Гальваническая пара это не что иное, как пара проводников, соединенных вместе с целью обеспечения электрического контакта, возможно, изготовленных из разных металлов. Каждый металл имеет свой электродный потенциал. При воздействии электролита один возьмет на себя роль катода, а второй роль анода, и между ними будет происходить коррозионный процесс, по итогам которого катод будет разрушать анод. В качестве электролита вполне сойдет влага из воздуха для приведения в действие электродного потенциала гальванической пары, при этом пары уязвимы в разной степени: одни больше, а другие меньше.
Гальваническая пара
В химии есть определенный порядок металлов, где они выставлены в последовательности, характеризующей их электродный потенциал в растворах электролитов, и называется она — электрохимический ряд напряжений металлов. Эта гальваническая шкала (Схема 1) может наглядно помочь разобраться, почему следует использовать крепеж из однородного материала.
Схема 1. Гальваническая шкала
Итак, исходя из этой шкалы, мы получаем следующее: когда два металла находятся в непосредственном контакте, то тот, что левее, будет корродировать, а тот что правее, будет более инертно защищенным. Необходимо достигать минимальной разности потенциалов между двумя изделиями:
- разница в 0,1 будет являться допустимо безопасной;
- разница в 0,2 будет являться допустимой при выполнении некоторых условий: — контактная коррозия не будет влиять на сохранность изделия и на потерю его рабочей способности; — в сборочной единице специально предусмотрена электрохимическая защита одного изделия за счет коррозии другого.
Также темп коррозии будет находиться в зависимости от площади поверхности открытых металлов. При условиях, если деталь более инертна, чем крепеж, крепеж будет коррозировать более ускоренными темпами. Например, использование оцинкованной метизной продукции для соединения нержавеющих сталей приведет к ускоренному образованию коррозии на метизах и ухудшению их механических свойств.
Гальваническая пара
Защита от электрохимической коррозии; какой металл будет катодом, а какой анодом в гальванической паре; допустимые, недопустимые и ограниченно допустимые контакты металлов — регламентируются ГОСТ 9-005-72 «Электрохимическая коррозия, допустимость контактов металлов».
В Таблице 1 представлены справочные данные некоторых металлов для определения совместимости.
Таблица 1. Справочные данные некоторых металлов для определения совместимости
В данной таблице можно увидеть, что использование нержавеющей стали и металлических изделий с нанесением цинкового покрытия недопустимо и приведет к образованию коррозии, что уменьшит срок службы изделий.
В случае, если нет возможности исключить образование недопустимой гальванической пары, стоит выполнить дополнительные действия по уменьшению контактной коррозии с помощью следующих способов:
- дополнительная установка неметаллических шайб, вставок или прокладок в местах соединений;
- изолирование соединения от воздействия окружающей среды;
- нанесение дополнительных металлических покрытий, совместимых между собой;
- покраска поверхностей в местах соединений;
- электрическая изоляция металлических изделий.
Данные процедуры стоит проводить, отталкиваясь от технических требований к изделию, от сроков и условий их эксплуатации и от экономической составляющей.
Пренебрежение требованиями к методам защиты от контактной коррозии может привести к поломке, потере работоспособности или разрушению изделий. Не исключено, что это приведет к дополнительным материальным затратам, нанесению морального или физического ущерба.
Коррозия металлов и сплавов
Металлы и сплавы подвержены разрушению под воздействием окружающей среды. Причина этого разрушения лежит в химических свойствах металлов — в их способности вступать в окислительно-восстановительные реакции с веществами окружающей среды и окисляться.
Самопроизвольное разрушение металлов и металлических материалов (сплавов) под воздействием окружающей среды называется коррозией.
Термин «коррозия» происходит от латинского слова corrosio — «разъедание».
Общеизвестным примером коррозии является ржавление железа.
Количество металлических материалов, используемых в народном хозяйстве, очень велико. Коррозии подвержены многие металлы и их сплавы (железо, алюминий, медь, свинец и др.). Стойкими против коррозии являются лишь благородные металлы: серебро, золото, платина. Коррозия приводит не только к полной потере металлических изделий, но и к потере металлами многих ценных качеств (твердости, пластичности и др.). Ежегодно из-за коррозии в мире безвозвратно теряется огромное количество металла, более 20 млн тонн. Еще более существенны экономические потери, связанные с порчей изделий из-за коррозии, затраты на ремонт, замену деталей, аппаратуры, приборов, которые во много раз превышают стоимость металлов, из которых они изготавливаются. Много и косвенных потерь из-за коррозии металлов: порча продуктов питания, утечки газа, нефти из испорченных трубопроводов и т. д. Поэтому борьба с коррозией является важнейшей проблемой человечества.
Чтобы бороться с коррозией, надо знать сущность этого процесса, механизм его протекания, условия, ускоряющие и замедляющие разрушение металла.
Проблема.
К каким процессам относится коррозия, в чем ее суть, каковы причины возникновения и условия протекания этого процесса?
Существуют разные виды коррозии металлов и их сплавов. Наиболее распространены два вида: а) химическая коррозия и б) электрохимическая.
Химическая коррозия — это вид коррозии, обусловленный непосредственным взаимодействием металла или сплава с сухими газами, жидкостями, не являющимися электролитами, твердыми веществами. Суть ее заключена в окислении металла в процессе непосредственного химического взаимодействия с веществами окружающей среды (газовая, жидкостная коррозия).
Примером газовой коррозии может служить окисление железа в атмосфере хлора:
- 2Fe + ЗСl2 = 2FeCl3
или окисление кислородом воздуха. При окислении воздухом на поверхности некоторых металлов образуются пленки из тончайшего слоя оксидов, защищающие в дальнейшем эти металлы от коррозии. Например, такая пленка возникает на поверхности никеля, хрома, меди, алюминия и других металлов. Для предотвращения коррозии на поверхности некоторых металлов специально создают такую защитную пленку, но более плотную, т. е. металл пассивируют (железо, хром, титан и другие металлы и их сплавы).
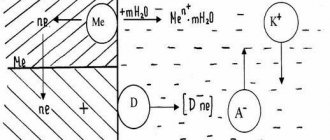
Электрохимическая коррозия — наиболее распространенный вид коррозии, приносящий наибольший вред металлам и изделиям из них. Электрохимическая коррозия возникает при контакте двух и более металлов одного сплава или металла с поверхностью изделия из другого металла в присутствии воды или другого электролита. В этом случае образуется гальванический элемент, электродами которого и являются металлы, находящиеся в растворе электролита (вода, в которой растворен углекислый газ, кислоты и др.). Возникает электрохимический процесс, т. е. наряду с химическими процессами, связанными с отдачей электронов и окислением металла, протекают и электрические (перенос электрона от одного участка металла к другому (рис. 74).
При возникновении гальванической пары сила возникающего электрического тока тем больше, чем дальше стоят друг от друга металлы в ряду напряжений. При этом поток электронов от более активного металла идет к металлу менее активному. Более активный металл при этом разрушается. Так, в паре Fe — Zn разрушается цинк; в паре Сu — Pt корродирует медь.
Схема действия гальванической пары (случай контактной коррозии, кусочек меди на железной поверхности, среда — кислая):
Примеры процессов электрохимической коррозии:
При контакте железа с оловом наблюдается обратная картина: интенсивность коррозии железа увеличивается.
Окончание параграфа >>>
Понятие о коррозии металлов
§ 5.
Большинство металлов легко разрушается под влиянием внешней среды — воздуха, воды, растворов кислот, щелочей, солей и т. д. Разрушение металлов, вызванное химическим или электрохимическим воздействием внешней среды, называют коррозией.
В результате коррозии преждевременно выходят из строя всевозможные машины, механизмы, приборы, металлические конструкции, по значимости и стоимости более ценные, чем металл, идущий на их изготовление.
По характеру разрушения металлов коррозию можно разделить на химическую и электрохимическую.
Химическая коррозия возникает вследствие реакции металла с сухими газами и жидкими диэлектриками (т. е. жидкостями, не проводящими электрический ток). Примером химической коррозии является окисление выхлопных клапанов двигателей внутреннего сгорания, жаровых труб, колосников топок и т. п.
Процесс разрушения металла при электрохимической коррозии сопровождается появлением электрического тока в результате взаимодействия металла с окружающей его средой, являющейся электролитом. К электрохимической коррозии относится разрушение металла в растворах кислот, щелочей и солей. Сплавы, структура которых состоит из кристаллов разного химического состава, легко поддаются коррозии. Железо, алюминий, хром и другие металлы после воздействия на них окислительных сред становятся пассивными, т. е. перестают корродировать. Это объясняется образованием на поверхности металлов защитной пленки окислов. Защитными пленками являются цвета побежалости на поверхности стали и окись алюминия (А1203) на поверхности алюминия.
В настоящее время разработаны следующие методы защиты металлов от коррозии:
легирование сплавов, состоящее в том, что в состав стального сплава вводят хром, молибден, никель, которые способны предупреждать и уменьшать коррозию;
искусственное создание окисных пленок на поверхности металлов или сплавов (оксидирование, анодирование);
удаление из внешней среды составляющих, вызывающих коррозию, например из воды удаляют кислород, способствующий коррозии, или для понижения активности воды в нее вводят около 0,5% хромпика, что устраняет в отдельных случаях коррозию;
нанесение металлических защитных покрытий гальваническим, диффузионным методом, методом набрызгивания, плакированием (прокаткой);
нанесение неметаллических покрытий на поверхность металлов (покрытие слоем лаков и красок);
электрозащита (подключение изделия к отрицательному полюсу источника тока), применяемая для предохранения от коррозии котлов и стальных деталей при термической обработке их в соляных ваннах;
протекторная защита, заключающаяся в том, что к защищаемой конструкции присоединяют кусок металла или сплава (протектор), активного в данной среде, который, разрушаясь сам, предохраняет конструкцию от коррозии.