20.04.2019 Автор: VT-METALL
Вопросы, рассмотренные в материале:
- Почему происходит коррозия металлических изделий
- Какой бывает коррозия металлических изделий
- Как предотвратить коррозию металлических изделий неметаллическими покрытиями
- Какие есть другие способы предотвращения металлических изделий от коррозии
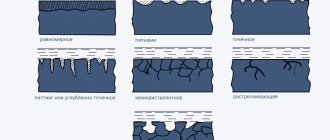
Взаимодействие металлов с окружающей средой приводит их к разрушению под влиянием электрохимических или химических процессов. В первом случае происходит растворение, обусловленное водной средой или влагой из воздуха, а во втором имеет место процесс формирования соединений с агрессивными веществами. Коррозия металлических изделий может образовываться на локальных участках (местная), охватывать всю поверхность детали (равномерная) или распространятся вдоль границ кристаллов (межкристаллитная).
Виды и причины возникновения коррозии металлических изделий
Взаимодействие металлов с окружающей средой приводит их к разрушению под влиянием электрохимических или химических процессов. В первом случае происходит растворение, обусловленное водной средой или влагой из воздуха, а во втором имеет место процесс формирования соединений с агрессивными веществами. Коррозия металлических изделий может образовываться на локальных участках (местная), охватывать всю поверхность детали (равномерная) или распространятся вдоль границ кристаллов (межкристаллитная).
Кислород и влага способствуют формированию на поверхности металла рыхлого порошка коричневого цвета (Fе2O3•H2О), который называют ржавчиной.
- Химическая коррозия
В этом случае разрушение металлических изделий происходит в средах, которые не являются проводниками электричества (сухие газы, нефтепродукты, спирты и другие органические жидкости). Химическая коррозия ускоряется с ростом температуры и приводит к образованию оксидной пленки.
Этому процессу подвержены все металлы без исключения. Наиболее активные из них, такие к примеру, как алюминий, в результате коррозии образуют оксидную пленку, которая защищает металлическое изделие от глубокого окисления. На поверхности меди и некоторых малоактивных металлов образуется налет, который называется патина. Следует отметить, что оксидная пленка может служить защитой от дальнейшего окисления только в том случае, когда ее кристаллохимическая структура сообразна строению металла. В других случаях такая пленка не защитит металлическое изделие от дальнейшего окисления.
Процесс коррозии в сплавах металлов протекает несколько иначе. Определенные элементы таких соединений вместо окисления восстанавливаются. К примеру, при высоких показателях температуры и давления в структуре сталей происходит восстановлением карбидов водородом, поэтому материалы теряют свои характеристики.
- Электрохимическая коррозия
Для протекания этого процесса не обязательно погружать металл в электролит. Электрохимическая коррозия может протекать под воздействием тоненькой электролитической пленки, образующейся на поверхности металла. Кроме того, растворы электролита могут находиться в среде, которая окружает металлическое изделие (в грунте, в бетоне и т.д.). Чаще всего электрохимическую коррозию провоцирует применение солей калия и натрия для борьбы с обледенением дорог и тротуаров в зимнее время. От такой коррозии сильно страдают автомобили, и различные инженерные коммуникации. Убытки, вызванные применением солей в Соединенных Штатах, после каждой зимы составляют около 2,5 млрд.$.
Извлечения из классической книги
И.Л.Розенфельд, В.П.Персианцева «Ингибиторы атмосферной коррозии», М., «ХИМИЯ», 1985г.
Факторы, влияющие на скорость атмосферной коррозии
Наиболее важными факторами, определяющими скорость атмосферной коррозии являются: влажность атмосферы; состав атмосферы; суммарная длительность пребывания пленки влаги, образовавшейся на поверхности металла; ее химический состав; температура воздуха.
Влажность атмосферы. Абсолютная влажность воздуха (количество водяного пара в единице объема воздуха) при неизменных других условиях определяет толщину адсорбционной пленки, образующейся на поверхности металла. Так, например, толщина слоя влаги, образующейся на поверхности железа при относительной влажности воздуха 55%, составляет 15 молекулярных слоев, а при относительной влажности 100% — 90 – 100 молекулярных слоев…
От относительной влажности зависит и количество воды, которое сконденсируется на поверхности металла при охлаждении изделия, однако и в этом случае при последующем ее испарении коррозия при меньших относительных влажностях, например при 76%, может оказаться выше, чем при 100% влажности. Сказывается эффект саморазмешивания… Малые скорости коррозии наблюдаются лишь при относительных влажностях до 60%. Превышение этой влажности при любом количестве сконденсированной на поверхности металла влаги приводит к резкому возрастанию скорости коррозии. Однако при большом количестве сконденсированной влаги коррозия при 80%-ной относительной влажности выше, чем при 100%.
Количество же сконденсированной на поверхности металла влаги зависит от температурного перепада: чем он выше, тем больше конденсируется воды при заданной влажности…
Количество сконденсированной влаги может изменяться также от присутствия на поверхности металла посторонних веществ. Их влияние сказывается на капиллярной конденсации. Кроме того, они способны стать центрами кристаллизации. Особенно опасны вещества, отличающиеся высокой гигроскопичостью. В их присутствии изменяются значения относительной влажности воздуха, при которой наблюдается резкое возрастание скорости коррозии металлов (Hk — критическая влажность)… Так, например, при наличии на поверхности железа аммонийных солей скорость коррозии резко возрастает, а влажность воздуха спускается с 80 до 50% …
Природа продуктов коррозии железа оказывает также сильное влияние на критическую влажность; для железа, покрытого продуктами коррозии, образованными в дистиллированной воде, критическая влажность равна 65%, а для морской воды критическая влажность снижается до 50% [194]…
Помимо снижения критической влажности посторонние частицы, осаждающиеся на поверхности металла, могут повышать скорость разрушения металлов вследствие изменения структуры защитных пленок, а также их адгезии с поверхностью металла.
Возникновение поверхностного натяжения между твердыми частицами и продуктами коррозии может приводить к тому, что последние будут прилипать к твердой частичке, а не к поверхности металла, ослабляя этим защитные свойства образующихся продуктов коррозии. Это наблюдается также в том случае, если природа частичек такова, что они могут взаимодействовать с переходящими в раствор ионами металла с образованием растворимых продуктов коррозии вместо нерастворимых гидроокисей металлов.
Отсюда следует весьма важный вывод: возникшие по каким-либо причинам продукты коррозии даже в виде мелких очагов должны быть возможно быстрее удалены, чтобы они не способствовали дальнейшему развитию коррозии. Следует также избегать попадания посторонних частиц на поверхность изделия.
Состав атмосферы. Агрессивные свойства атмосферы по отношению к металлам определяются не только влажностью, но и теми загрязнениями, которые в нее попадают. Самыми неблагоприятными видами загрязнений являются сернистый газ и хлористый натрий. Первый попадает в атмосферу вместе с продуктами, образующимися при сжигании сернистого топлива, второй – за счет соли, уносимой ветром с поверхности океанов и морей.
Сернистый газ. С некоторой критической концентрации сернистый газ сильно увеличивает скорость коррозии таких металлов, как железо, алюминий, цинк, медь и другие… При постоянной концентрации сернистого газа в атмосфере скорость коррозии металлов возрастает с повышением относительной влажности атмосферы… Возрастание скорости коррозии металлов наблюдается и в том случае, когда в атмосфере нет сернистого газа, но поверхность металла предварительно подвергалась его воздействию. Коррозия при этом протекает так, как будто атмосфера содержит сернистый газ … такой отрицательный эффект связан с тем, что сернистый газ в присутствии адсорбированной влаги на металле образует кристаллогидраты, которые не удаляются с поверхности металла даже при откачке и способствуют возникновению и развитию коррозионного процесса. Наиболее опасными в промышленной атмосфере являются оседания на поверхности конструкции частичек угольной пыли…
Хлористый натрий. Хлористый натрий, подобно сернистому газу, весьма заметно усиливает коррозию ряда металлов в атмосферных условиях… Основной причиной ускорения коррозии хлористым натрием является образование в его присутствии растворимых продуктов коррозии вместо нерастворимых гидроокисей, возникающих под чистой пленкой влаги. Кроме того, ионы хлора препятствуют образованию пассивирующих пленок. Агрессивное действие хлористого натрия в условиях атмосферы следует также связывать с его способностью адсорбировать влагу из относительно сухих атмосфер. Уже при относительной влажности воздуха, равной 70%, хлористый атрий адсорбирует влагу, что сопровождается сильным увеличением скорости коррозии…
Из других загрязнений воздуха наиболее агрессивными являются хлор, аммиак, сероводород и углекислый газ… Не останавливаясь подробно на рассмотрении влияния этих загрязнений атмосферы на механизм и скорость коррозионных процессов, отметим то общее, что есть в действии этих соединений, а также их некоторые отличительные особенности.
Отличительной особенностью хлора является его агрессивность как во влажных, так и в относительно сухих атмосферах (Н = 42%)… При высоких относительных влажностях наступает резкое возрастание скорости коррозии. Последнее связано с тем, что хлор является сильным катодным деполяризатором при высоких относительных влажностях. Кроме того, в результате образования хлористых соединений он сдвигает критическую влажность к более низким значениям.
Коррозионная активность сероводорода, подобно сернистому газу, наступает лишь при достижении определенного значения относительной влажности атмосферы… В сухой атмосфере в присутствии сероводорода коррозия цинка, кадмия, олова, алюминия, сурьмы, висмута, хрома, железа, чугуна, легированных сталей, кобальта и никеля ничтожна… Общим для рассматриваемых видов загрязнений является их более низкая (в большинстве случаев) агрессивность по сравнению с сернистым газом и хлористым натрием. Аммиак сам по себе для железа и сплавов на его основе не опасен. Однако для медных сплавов он представляет большую опасность, вызывая коррозионное растрескивание.
Продолжительность пребывания пленки влаги на поверхности металла… в атмосферах, не загрязненных заметными количествами специфических коррозионно-активных примесей, процесс атмосферной коррозии возникает и развивается лишь в том случае, если на поверхности металла присутствует пленка влаги определенной толщины (10-20 молекулярных слоев), приобретающая свойства электролита. Продолжительность развития коррозионного процесса и количество металла, превратившегося в продукты коррозии, зависит от длительности пребывания пленки электролита на поверхности металла. Чем дольше не высыхает пленка, образовавшаяся на металле, или чем чаще она возобновляется, тем дольше протекает процесс коррозии, а следовательно, при всех прочих равных условиях тем большему коррозионному разрушению подвергается металл…
Существенное значение длительности общего времени пребывания пленки влаги для коррозионного разрушения подтверждается также тем, что, например, в Батуми, где выпадает максимальное по Союзу количество осадков (число дней с росой – 68) и где, казалось бы, коррозия должна быть наибольшей, она оказывается ниже, чем, скажем, в приморских условиях Мурманска, где количество осадков значительно меньше число дней с росой – 25). Это объясняется тем, что в Батуми, где много солнечных дней, условия для удаления пленки с поверхности металла более благоприятны, чем в Мурманске. Поэтому общее время контакта металла с электролитом в Батуми значительно меньше, чем в Мурманске, а следовательно, и коррозия там меньше. Этим же эффектом можно объяснить, почему сильнее корродирует та сторона образца или конструкции, которая обращена к земле, а не та, на которую непосредственно выпадают атмосферные осадки.
Температура воздуха. Скорость коррозии с температурой обычно возрастает, поскольку с ростом температуры увеличивается кинетика электрохимических реакций, обусловливающих коррозионный процесс.
При атмосферной коррозии, протекающей … в видимых слоях электролитов, чаще всего с катодным ограничением, температура изменяет скорость процесса главным образом благодаря изменению кинетики катодной реакции восстановления кислорода, скорость которой определяется скоростью диффузии кислорода к электроду.
Поскольку коэффициент диффузии кислорода с температурой растет (коэффициент диффузии изменяется по закону D = RT / (6p r h),
где R – постоянная Больцмана; r – радиус диффундирующей частицы; h – вязкость среды), а толщина диффузионного слоя уменьшается (вследствие усиления саморазмешивания, обусловленного конвекцией), то повышение температуры должно привести к росту предельного диффузионного тока и, следовательно, скорости коррозии. Необходимо, однако, иметь в виду, что при коррозии металлов в атмосфере с изменением температуры меняется длительность контакта электролита с металлом. Поэтому общий коррозионный эффект зависит от изменения кинетики электродных реакций и от изменения времени пребывания электролита на поверхности металла.
Ввиду наличия двух факторов, действующих в прямо противоположном направлении (длительность контакта металла с электролитом уменьшается с повышением температуры, а скорость реакций, обусловливающих коррозионный процесс, увеличивается), зависимость скорости атмосферной коррозии от температуры является весьма сложной и ее не всегда легко предсказать. Если эффекты, возникающие от длительного пребывания металла в контакте с электролитом, превышают эффекты, возникающие за счет более интенсивного протекания процесса при более высокой температуре, то коррозия в районах, характеризующихся относительно низкой температурой, может быть больше, чем в районах, отличающихся высокими температурами. Однако высокие температуры, сочетающиеся с длительным пребыванием металла в контакте с электролитом, что, например, наблюдается во влажном тропическом климате, способствуют усиленной коррозии
Электрохимический способ защиты от коррозии металлических изделий
Классические методы предупреждения металлических изделий от коррозии основаны на покрытии изделия электролитическим способом чистым металлом или специальным сплавом. В таблице приведены наиболее популярные покрытия, которые могут наноситься с применением электрохимической обработки.
Данный метод антикоррозийной защиты металлических изделий хорошо изучен и может применяться для большинства металлов и разных сплавов. Защитное покрытие наносится на электропроводящую основу. Технология данного процесса обеспечивает возможность регулирования толщины и характеристик покрытия путем изменения состава электролита, параметров тока и температуры. При точном соблюдении технологических требований обеспечивается высокое качество защитного покрытия. При необходимости, электрохимический способ защиты металлических деталей позволяет получать зеркальные поверхности без дополнительной полировки.
Стоимость оборудования для такой обработки является довольно доступной.
Рекомендуем статьи по металлообработке
- Марки сталей: классификация и расшифровка
- Марки алюминия и области их применения
- Дефекты металлический изделий: причины и методика поиска
Данная технология нанесения защитных покрытий не отличается высокой производительностью (порядка (10 — 50 мкм/час на м2), что обусловлено невысоким уровнем применения непрерывных методик и внедрения технологических линий для обработки рулонных материалов. В РФ стальной прокат с электролитическим покрытием под маркой «Полистил» серийно выпускает только Листвянский МЗ. В каталоге продукции этого предприятия представлена тонколистовая оцинкованная сталь марок ЭОЦ, ЭЦ, освинцованный прокат ЭОС, хромированная жесть и другие виды продукции с электрохимическими покрытиями.
Данная технология антикоррозийной защиты металла применяется многими отечественными компаниями, которые осуществляют производственную деятельность в разных областях.
Коррозия – одна из основных проблем при эксплуатации металлических конструкций
Проблема коррозии гораздо более серьезная, нежели ей, зачастую, придают значение. Ее актуальность особенно проявляется на предприятиях, где используются металлические конструкции, оборудование, техника, инструментарий и транспорт со значительным износом срока службы. Процессы коррозии имеют разную природу своего возникновения, но всех их связывает одно – они появляются в результате соприкосновения и взаимодействия металлов со средой (физико-химической и химической). В основном она протекает в жидкостной и газообразной среде. Что же происходит с металлами, попавшими в так называемую «коррозионную» зону? Дело в том, что эти материалы имеют недостаточную термодинамическую устойчивость к определенным веществам, с которыми они взаимодействуют. Проявлением коррозии являются ее продукты, такие как ржавчина.
Этот процесс крайне негативно влияет на оборудование и ведет к разрушению заданий и разнообразных конструкций. Экономике Российской Федерации подобная проблема наносит колоссальный ущерб, который практически невозможно оценить. По данным специалистов, убытки от коррозии могут составлять от 3 до 5 % ВВП стран, с развитой промышленностью. Более того, ржавчина и другие коррозионные последствия, буквально, «съедают» металл. Его потери по оценкам экспертов могут доходить до 20%. Коррозия незаметно и скрытно может нарушить прочность материалов и привести к серьезным авариям и чрезвычайным ситуациям, в том числе к человеческим жертвам. Восстановление конструкций, пришедших в негодность от коррозии и замена оборудования по этой же причине, обходятся их владельцам в огромные средства.
Проблема коррозии на опасных производственных объектах может спровоцировать аварии и чрезвычайные ситуации, которые чреваты серьезными экологическими проблемами, а также несчастными случаями с причинением вреда здоровью и жизни персонала.
Защита материальной части промышленных предприятий от ржавчины и других коррозионных процессов является сегодня актуальным вопросом в части обеспечения промышленной безопасности.
Для этого профильные специалисты должны четко себе представлять процессы образования ржавчины, обладать знаниями о физико-химических свойствах металлов и способах защиты от коррозии, которая присутствует везде, где осуществляется обработка и эксплуатация изделий из металла. С ней можно и нужно бороться. Гораздо проще предотвратить коррозионные процессы, нежели их потом устранять.
Одним из самых эффективных способов защиты металлических конструкций, причем на длительный срок, является покрытие его поверхности тонким слоем цинкованной пленки, которая препятствует проникновению внутрь металла кислорода. А именно его присутствие и ведет к ржавчине.
По данным статистики, на одного российского жителя приходится 4 кг. металла, покрытого цинком. Аналогичный показатель на Западе составляет 15 кг. Подобная информация крайне показательна и отражает проблемность этой темы в России, где огромное количество металла практически не защищено от ржавчины и ее последствий. Это ведет к тому, что срок годности оборудования и металлоконструкций резко сокращается и в определенный момент становится опасным для дальнейшей их эксплуатации.
Эксперты в области безопасности бьют тревогу по поводу применения при строительстве жилых домов металлических конструкций и арматуры без антикоррозионного покрытия. Например, на Западе это категорически воспрещается. Подобная практика порочна и опасна. Приблизительно через 5 лет незащищенная от коррозии арматура, находящаяся в бетоне внутри жилого здания, покрывается ржавчиной. Фактическую безопасность подобных зданий не сможет оценить даже профессионал в этой области.
Специалисты утверждают, что проблема имеет системный характер. В настоящее время в Российской Федерации нет ни одного завода, который производит специальное оборудование по горячему покрытию цинком металлических поверхностей. Но, поскольку потребность в этой технологической операции существует, то российские предприятия вынуждены приобретать аналогичное оборудование за рубежом. И здесь возникает новая проблема, заключающаяся в том, что закупается старое, изношенное оборудование по высоким ценам и с ненужными дополнительными функциями. Учитывая, что отечественных квалифицированных кадров в этой сфере практически нет, то технологический процесс, соответственно, нарушается. Бывают прецеденты, когда металлические конструкции покрываются ржавчиной, будучи оцинкованными, едва доехав до места строительства.
Но, нельзя сказать, что этой проблемой в России совсем не занимаются. Уже есть отечественные разработки и технологии российских ученых в области антикоррозионного покрытия, которые в состоянии обеспечить защиту металлоконструкций от ржавчины на длительный срок. Кроме того, это оборудование более эффективно по производительности и гораздо меньшей цены. Например, очень востребована новая уникальная технология отечественных ученых по нанесению алюминия на стальные поверхности (стальной прокат). По мнению специалистов, эта технология является инновационным прорывом в области антикоррозийного покрытия. Дело в том, что алюминиевое нанесение намного эффективней оцинкованного покрытия, причем существенно (в 5-10 раз). Такой металл при высоких температурных режимах более устойчив, чем тот же цинк. Преимущество алюминиевого покрытия заключается еще и в том, что он не разрушает свои внутренние структурные связи в так называемых агрессивных средах, причем при температуре, достигающей 900С. Достоинство этого металла по сравнению со своими конкурентами также в его весе и расходных нормах нанесения вещества на его поверхность.
Но экспертное сообщество в этой области считает, что решить проблему продвижения и внедрения отечественных технологий и разработок в промышленное производство без участия государства невозможно. И начинать этот процесс, по их мнению, необходимо с формирования новой законодательной базы, позволяющей развивать инновационные разработки в области антикоррозионного покрытия и стимулировать промышленность к их внедрению.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Предотвращение коррозии металлических изделий горячим цинкованием
Горячее цинкование можно назвать наиболее простым, но, при этом, наиболее старым способом защиты металла от , строительных конструкций, уголка и проволоки.
- Подготовка поверхности металлических изделий
Перед тем, как нанести на поверхность стальных деталей расплавленный цинк необходимо провести некоторые подготовительные работы. От того, насколько качественной будет подготовка изделий зависит степень адгезии покрытия с металлом. Подготовительные работы выполняются в несколько этапов. Вначале металлическая поверхность обезжиривается, затем, промывается, подвергается травлению и флюсованию.
Тщательное обезжиривание поверхностей изделий из металла необходимо для удаления масляных пятен и различных загрязнений. Для этой операции часто используются кислоты и щелочные растворы. В зависимости от характера загрязнения для обезжиривания могут использоваться те или иные реагенты. Эта операция осуществляется при температурах от 60 °C до 80 °C. После этого металлическое изделие нужно тщательно промыть, чтобы удалить остатки реагентов, пены, жира и т.д.
На следующем этапе деталь подвергают травлению. Чтобы убрать остатки ржавчины и окалину изделие погружают в раствор HCl с концентрацией 120 — 210 г/л. Такая операция обеспечивает эффективную очистку металлических деталей, что является необходимым условием для обеспечения адгезии цинкового покрытия с металлом. При этом, чтобы кислота не разрушала обрабатываемую деталь, в ее раствор включают особые ингибиторы, предотвращающие абсорбцию водорода (наводороживание).
После завершения травления деталь нужно еще раз промыть, чтобы убрать остатки раствора. Для более экономного расхода воды и удобства при промывке используют последовательно расположенные ванны.
При контакте с водой на поверхности металлических изделий формируются окислы, которые удаляют флюсованием. Эта операция позволяет полностью очистить металл и получить на его поверхности пассивный пленочный слой, защищающий от окисления и обеспечивающий хорошую адгезию с цинком.
Для флюсования используют состав, включающий NH4Cl и ZnCl2. К примеру, на производстве часто используют флюсы, содержащие 55,4% хлорида аммония, 6% глицерина и 38,4% хлорида цинка. Эта процедура выполняется концентрированным раствором (400 — 600 г/л) при 60 °C. При этом необходимо постоянно контролировать состав раствора и своевременно очищать ванну (для этого в нее добавляют H2O2). При добавлении перекиси водорода в ванне оседают соли Fe3+, которые собирают в специальные отстойники и отфильтровывают.
- Сушка металлических изделий перед горячим цинкованием
После флюсования деталь необходимо тщательно просушить. В противном случае остатки воды на поверхности металла при погружении в расплавленный цинк начинают испаряться, что приводит к микровзрывам и нарушает целостность цинкового слоя. Кроме того, сушка деталей позволит сократить расход тепловой энергии на поддержание стабильной температуры расплавленного цинка. Длительность процесса сушки превышает продолжительность самого цинкования. Для просушивания металлические изделия помещают в сушильную печь, разогретую до 100°C.
- Горячее цинкование
Чтобы обеспечить надежную защиту металлических деталей от коррозии необходимо обеспечить следующие составляющие: высокое качество цинка и металла, точное поддержание температурного режима, правильная предварительная подготовка изделия, необходимая скорость погружения/поднятия и определенная длительность погружения, соблюдение требований к режиму охлаждения.
При погружении в расплавленный цинк флюс оплавляется, обеспечивая необходимую смачиваемость поверхности. Слишком медленное погружение приводит к слишком раннему расплавлению флюса и появлению окислов на поверхности металлического изделия. Из-за слишком быстрого погружения флюс не успеет расплавиться, и цинковое покрытие будет иметь дефекты. Поэтому, важно точно соблюдать требования по скорости погружения изделия в ванну.
Технология горячего цинкования предусматривает нахождение металлических изделий в ванне с расплавленным цинком от 3 до 10 минут. В течение этого времени поверх расплава формируется слой шлака. Прежде, чем достать деталь необходимо очисть ее от этого шлака с помощью специального скребка. В противном случае он осядет на оцинкованном изделии.
Скорость, с которой будет извлекаться металлическая деталь из расплавленного цинка, влияет на толщину защитного слоя (более толстое покрытие получается при медленном извлечении). Это связано со скоростью кристаллизации. Продолжительность подъема и наклон изделия определяется индивидуально, исходя из его формы и размеров. Процесс сушки детали после горячего цинкования осуществляется на открытом воздухе.
Для удаления и дальнейшей утилизации паров HCl и других вредных веществ над всеми ваннами производственной линии устанавливают вентиляционные системы высокой мощности.
Новейшие линии, которые выполняют процесс горячего цинкования, работают полностью в автоматическом режиме. Более старое оборудование управляется операторами с помощью контрольных пультов, что предотвращает непосредственный контакт работников с вредными испарениями.
Преимущества защиты металлических изделий от коррозии с помощью технологии горячего цинкования:
- на поверхности детали формируется покрытие, отличающееся высокой коррозионной устойчивостью;
- доступная стоимость;
- простота технологического процесса;
- простота обслуживания оборудования;
- высокая производительность;
- покрытие, образовавшееся после горячего цинкования, обеспечивает защиту металлических изделий даже от механических повреждений;
- полученное покрытие отличается высокой электропроводимостью и теплопроводностью;
- горячецинковое покрытие препятствует хрупкость металла вследствие воздействия атомарного водорода.
Недостатки технологии:
- размер деталей, которые могут обрабатываться по методу горячего цинкования, ограничен габаритами ванны;
- оцинкованные металлические изделия плохо подвержены дальнейшей обработке и сварке;
- относительная неравномерность цинкового слоя;
- с помощью горячего цинкования невозможно получить очень тонкие покрытия;
- относительно большой расход цинка.
Данная технология позволяет создавать на поверхности металлических изделий защитный слой от нескольких микрон до одного миллиметра.
Коррозия трубопроводов — причины и последствия. Часть 1. Магистральные трубопроводы
Трубопроводный транспорт — самый распространенный способ доставки жидких и газообразных сред в мире. Небольшие внутренние трубопроводы есть в каждом современном доме, в населенных пунктах построены сети надземных и подземных распределительных трубопроводов, все регионы нашей страны соединены системой магистрального трубопроводного транспорта. Трубопроводы транспортируют воду, нефть и нефтепродукты, газ и т.д. В нашей стране был построен даже уникальный трубопровод транспорта аммиака. Большинство отечественных эксплуатируемых трубопроводов — металлические, главная причина их разрушений — коррозия, а видов коррозии — множество. В данном обзоре мы кратко рассмотрим основные виды коррозии трубопроводов в зависимости от их назначения, а также немного поговорим о последствиях коррозионных аварий.
Причины коррозии всегда определяются свойствами коррозионно-опасной среды, с которой контактирует внутренняя и наружная поверхность трубопровода. Коррозия внутренней поверхности трубопроводов имеет место в основном при перекачке водных сред, особенно если в них растворены коррозионно-опасные вещества: соли, кислоты, щелочи и т.д. Такая ситуация реализуется на всех водоводах, в частности в системах отопления и горячего водоснабжения, системах нефтесбора (помним, что в РФ в добываемой из скважин нефти содержится до 99% воды!), сточных водах промышленных предприятий. Самый опасный последний случай. Коррозия наружной поверхности зависит от способа прокладки трубопровода и примененных конструктивных решений. Например, при прокладке методом «труба в трубе» коррозия наружной поверхности не происходит. При прокладке трубопровода на воздухе протекает атмосферная коррозия, которая практически не приводит к нарушению целостности трубопровода (образованию сквозных дефектов). Процессу атмосферной коррозии мы уже посвятили отдельный обзор, поэтому в данной статье к этому вопросу возвращаться не будем. Основная опасность коррозионного разрушения наружной поверхности трубопроводов возникает при подземной прокладке, причем назначение трубопровода в данном случае не слишком принципиально. За небольшим исключением, все типы трубопроводов под землей корродируют одинаково. Отдельный вопрос — подводная коррозия трубопроводов, проложенных по дну, без заглубления в грунт. Правда этот сугубо специфичный вид коррозии касается всего нескольких объектов в РФ — морских магистральных газопроводов, например, Голубой поток и Северный поток, а также нескольких промысловых трубопроводов в Каспийском, Черном и северных морях. В связи с крайней узостью заинтересованного круга лиц и специфичностью процессов морская коррозии наружной поверхности трубопроводов в этом обзоре также не будет затрагиваться.
Итак, мы начинаем. В данном обзоре, разделенном на несколько частей, мы отдельно и подробно рассмотрим возможные механизмы коррозии следующих видов трубопроводов, классифицированных по их функциональному назначению:
- магистральные трубопроводы;
- промысловые трубопроводы месторождений нефти и газа;
- трубопроводы систем отопления, горячего и холодного водоснабжения;
- трубопроводы промышленных сточных вод.
Начнем, пожалуй, с наиболее простых с коррозионной точки зрения объектов — магистральных трубопроводов транспорта нефти, газа, аммиака, нефтепродуктов и т.д.
Коррозия магистральных трубопроводов
Пожалуй, это самый хорошо изученный и систематизированный вид коррозии трубопроводов. По крайней мере, магистральные трубопроводы — это единственный вид трубопроводов, защита от коррозии которых регламентируется отдельным национальным стандартом ГОСТ Р 51164-98* «Трубопроводы стальные магистральные. Общие требования к защите от коррозии». Конечно, ГОСТ Р 51164-98* в основном посвящен методам противокоррозионной защиты, а не механизмам коррозионного разрушения, однако, при его внимательном изучении можно выделить и определенную систематизацию опасности коррозии магистральных трубопроводов в зависимости от ее механизма. Сразу следует отметить, что магистральные трубопроводы используются для транспорта подготовленных коррозионно-инертных продуктов, поэтому для них опасность представляет только наружная коррозия, причем на участках надземной прокладки только сравнительно неопасная атмосферная коррозия
. Далее наш обзор будет посвящен только участкам магистральных трубопроводов подземной прокладки.
Итак, ГОСТ выделяет 3 вида участков магистральных трубопроводов, подверженных особым коррозионным опасностям: участки высокой коррозионной опасности, участки повышенной коррозионной опасности и коррозионно-опасные участки. Среди критериев ГОСТ, касающихся механизмов коррозии и позволяющих отнести некоторые участки трубопроводов к особо опасным участкам, можно выделить следующие критерии участков повышенной коррозионной опасности:
- блуждающие токи от источников постоянного тока;
- микробиологическая коррозия;
- коррозионное растрескивание под напряжением.
Дополнительно, ГОСТ относит к участкам повышенной коррозионной опасности участки прокладки магистральных трубопроводов, на которых может резко возрасти опасность обычной почвенной коррозии:
- участки трубопроводов в засоленных почвах любого района страны (солончаковых, солонцах, солодях, сорах и др.);
- участки трубопроводов на участках промышленных и бытовых стоков, свалок мусора и шлака;
- участки трубопроводов с температурой транспортируемого продукта выше 303 К (30 °С).
Обобщая вышесказанное, а также многолетний опыт эксплуатации и диагностики, можно резюмировать, что на магистральных трубопроводах подземной прокладки в основном реализуются следующие виды коррозионного разрушения:
- почвенная электрохимическая коррозия;
- коррозия блуждающими токами от источников постоянного тока;
- коррозия блуждающими токами от источников переменного тока (на участках пересечений и реже сближений с ВЛ 110 кВ и выше);
- коррозионное растрескивание под напряжением (свойственно преимущественно магистральным газопроводам);
- микробиологическая коррозия (на участках, где почва вокруг трубопровода заражена микроорганизмами).
Почвенная электрохимическая коррозия
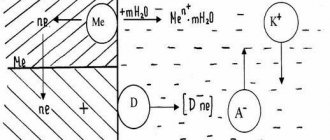
Коррозия подземных трубопроводов протекает по электрохимическому механизму, базирующемуся на возникновении разности потенциалов между различными участками трубопровода, и, как следствие, возникновении тока коррозии. В результате протекания тока коррозии участки металла на анодных зонах растворяются и переходят в грунт, где впоследствии взаимодействуют с почвенным электролитом, образуя ржавчину.
Механизм электрохимической коррозии
Одной из наиболее важных особенностей трубопроводов, с точки зрения коррозии, является их большая протяженность. При своей большой протяженности подземные линии проходят через почвы различного состава и строения, различной влажности и аэрации. Все это создает возможность возникновения значительных разностей потенциалов между отдельными частями подземной линии. Так как трубопроводы имеют высокую проводимость, то на них легко образуются коррозионные гальванопары, имеющие иногда протяженность в десятки и даже сотни метров.
Так как при этом часто создаются большие плотности тока на анодных участках, это сильно увеличивает скорость коррозии. Существенным для развития коррозии оказывается и то, что подземные линии укладываются на такой глубине, где всегда сохраняется некоторая влажность, обеспечивающая течение коррозионных процессов. На глубине заложения трубопроводов температура редко снижается ниже 00С и это также способствует коррозии. Благоприятствует развитию коррозии на подземных трубопроводах и наличие на поверхности труб прокатной окалины, которая далеко не всегда удаляется при очистке.
Было установлено наличие прямой зависимости между площадью, подвергающейся коррозии, и глубиной коррозионного разрушения. Это объясняется тем, что на большей поверхности металла существует большая возможность создания более тяжелых коррозионных условий. В частности, этим объясняется, что другие стальные подземные сооружения, помимо трубопроводов, при прочих равных условиях разрушаются электрохимической коррозией медленнее.
Коррозионная агрессивность самих почв определяется их структурой, гранулометрическим составом, удельным электрическим сопротивлением, влажностью, воздухопроницаемостью, рН и др. Обычно коррозионную агрессивность грунта по отношению к углеродистым сталям оценивают по удельному электрическому сопротивлению грунта, средней плотности катодного тока при смещении электродного потенциала на 100 мВ отрицательнее коррозионного потенциала стали, градиенту естественных потенциалов свободной коррозии на участке трубопровода.
Коррозия блуждающими токами от источников постоянного тока
Блуждающие токи — это токи антропогенного происхождения, протекающие в земле и в подземных металлических конструкциях. Такие токи возникают за счет утечек в землю токов эксплуатируемых устройств и сооружений, работающих на постоянном токе, в частности железных дорог на постоянном токе, электросварочных аппаратов, систем катодной защиты сторонних объектов и т.д., и т.п. Как известно, электрический ток всегда стремится двигаться по пути наименьшего сопротивления, поэтому при наличии в зоне распространения блуждающих токов в земле подземных протяженных металлических трубопроводов, электропроводность которых в разы больше электропроводности почвы, блуждающий ток будет протекать именно по ним. В наиболее удачном месте (с точки зрения того же самого принципа наименьшего сопротивления) блуждающий ток стечет с трубопровода обратно в землю и вернется к своему источнику. При этом участок трубопровода, из которого блуждающий ток выходит в землю, является анодом, а та часть трубопровода, где блуждающий ток попадает в него, является катодом. На анодных участках блуждающие токи повышенной плотности вызывают значительные коррозионные повреждения трубопроводов, скорость коррозии на них практически неограниченна и может достигать гигантских значений 10-20 мм/год.
Коррозия блуждающими токами от источников переменного тока
Данный вид коррозии встречается в местах сближения и параллельного следования ВЛ напряжением 110 кВ и выше и магистральных трубопроводов. Это явление уже подробно освещено на нашем сайте в специальном обзоре
и в настоящей статье дополнительно рассматриваться не будет.
Коррозионное растрескивание под напряжением (КРН) или стресс-коррозия
Коррозионное растрескивание под напряжением в магистральных трубопроводах (в основном газопроводах) развивается в результате одновременного воздействия на металл коррозионной среды и растягивающих напряжений. Благодаря проведенным исследованиям, в настоящее время сформировалась водородно-коррозионная теория развития КРН в трубопроводах.
Формирование и развитие микротрещин в металле происходит в результате наводораживания трубной стали в местах дислокаций и вакансий кристаллической решетки и роста в них внутреннего давления до значений, превышающих эквивалент энергии связи атомов решетки. Само наводораживание происходит вследствие протекающих процессов диффузии протонов (H+), образующихся в результате гидролиза воды при повышенных потенциалах катодной защиты, диссоциации ряда неорганических соединений, таких как гидрокарбонаты, гидросульфиды и сульфиды, нитраты, аммонаты, фосфаты и т.д., жизнедеятельности сульфатвосстанавливающих организмов.
После раскрытия трещин на поверхности трубы в местах повреждения изоляционного покрытия трубопровода происходит ускорение трещинообразования за счет коррозионного влияния электролита грунта, проникающего в трещины.
Конечный этап деструкции (включая долом трещин) контролируется условиями механической нагрузки на трубопровод, напряженно-деформированным состоянием трубной стали, а также ее прочностными характеристиками.
Микробиологическая коррозия
Микробиологической коррозией (или биокоррозией) называют коррозию металла, которая возникает в результате жизнедеятельности микроорганизмов. В почвах и природных поверхностных водах содержится огромное количество микроорганизмов — бактерии, грибки, водоросли, простейшие и т.д. В настоящее время установлено, коррозию металла инициируют в большинстве случаев именно бактерии из-за высокой скорости их размножения и активности в химических преобразованиях окружающей среды. Для протекания процесса микробиологической коррозии вызывающие её бактерии должны находиться во влажной или водной среде, также им нужен азот, минеральные соли и ряд других элементов. Необходимо наличие вполне определённых внешних условий, при которых они начинают активно размножаться вблизи трубопровода, таких как:
- температура;
- давление;
- освещённость;
- концентрация водородных ионов;
- концентрация кислорода.
Микроорганизмы могут вызывать коррозию путём продуцирования веществ, вызывающих коррозию (например, кислот), создавая на поверхности металла условия, которые обуславливают появление на поверхности металла разности потенциалов и образования дополнительных анодных и катодных зон, с дальнейшим протеканием коррозионного процесса по электрохимическому механизму.
В случае магистральных трубопроводов наиболее часто встречается микробиологическая коррозия, инициируемая сульфатвосстанавливающими бактериями. Под действием этих бактерий на трубах образуются отдельные каверны. Продукты коррозии имеют чёрный цвет и запах сероводорода. Они содержат около 40% двухвалентного железа и 5% серы в виде сульфидов. Сульфатвосстанавливающие бактерии присутствуют практически во всех грунтах, но заметный коррозионный процесс происходит только тогда, когда присутствует их относительно большое число.
Итак, в настоящей статье мы кратко изложили виды и механизмы коррозии магистральных трубопроводов. Продолжение начатой темы, посвященное водопроводным системам, читайте здесь.
Плакирование – еще один способ защиты металлических изделий от коррозии
Технология покрытия металлических деталей защитным антикоррозийным слоем из другого металла методом пластической деформации называется плакированием. Данный процесс обработки основан на холодной сварке, позволяющей формировать атомарные связи между металлами без взаимного проникновения материалов.
Плакирование, как правило, используется для формирования защитного слоя или декоративных металлических покрытий на деталях, которые изготовлены из нержавейки, конструкционной стали, а также медных и алюминиевых сплавов. Этапы обработки при данной технологии зависят от способа сжатия металлов и выглядят следующим образом:
- Подготовительные мероприятия, включающие очистку обрабатываемой детали механическими и химическими способами.
- Фиксация на поверхности изделия металла (листового, порошкового или трубчатого), который используется для плакирования.
- Сжатие материалов, позволяющее обеспечить их деформацию, которая будет достаточной для их взаимного проникновения путем формирования атомарных связей.
Данная технология может использоваться для обработки штучной или погонной продукции (листы, труба, пруток). Процедура нанесения на металлические изделия слоя, защищающего от коррозии, может быть непрерывной или циклической.
В соответствии с производственной необходимостью технология плакирования позволяет обрабатывать до 6 слоев металла (включая основной). Толщина получаемых слоев находится в пределах от десятых частей до нескольких единиц миллиметров. Необходимым условием для применения технологии плакирования является сочетаемость основного материала с плакирующим слоем, которая определяется однородностью кристаллических решеток.
Наиболее распространенные методы пластической деформации металлов, использующиеся для защиты металлических изделий от коррозии с помощью технологии плакирования:
- Прокатка. В этом случае несколько слоев (от 2-х до 4-х) длинномерного металла протягивают через вальцы. Особенности технологии многослойного плакирования определяются твердостью металлических листов и их расположением в пакете.
- Экструзия позволяет осуществлять наружное и внутренне плакирование изделий цилиндрической формы (трудная продукция, проволока, круглый прокат). Для этого метода используют плакирующий материал в виде трубки, которая крепится снаружи на обрабатываемом изделии. Пластическая деформация материалов осуществляется на этапе прохождения заготовок через фильеру.
- Штамповка. В этом случае лист плакирующего материала накладывают на обрабатываемое изделие и прижимают, параллельно выполняя штамповку рельефных поверхностей.
- Сваривание взрывом. Над соединяемыми элементами размещают накладные заряды взрывчатки, при срабатывании которой осуществляется их резкое сжатие. Такая технология дает возможность осуществлять плакирование металла большой толщины.
Чтобы обеспечить необходимую пластичность соединяемых материалов, их могут нагревать с помощью СВЧ-излучателей до нужной температуры. К наиболее современным методам плакирования относят обработку с применением лазерного оборудования. Такие устройства оснащены рабочим органом, в который обеспечивает подачу металлического порошка непосредственно в лазерный луч. Металл расплавляется и в виде струи направляется на поверхность детали.
Последствия коррозии
Коррозии не подвергаются лишь металлы, которые встречаются в чистом — самородном виде. Например, золото, серебро, платина. Но таких очень мало.
Другие металлы под воздействием влаги возвращаются в свое природное состояние в виде химических соединений — оксидов, солей и гидроксидов, из которого человек извлек их путем сложных физико-химических манипуляций.
В результате окружающая среда загрязняется соединениями тяжелыми металлами. Они попадают в ливневую канализацию или ручей, а оттуда — в реки.
Нерастворимые в воде соединения через какое-то время оседают на дно городских рек. Если поднять грунт со дна, то это будет не плодородный ил, как в древнем Египте, а мертвая загрязненная соединениями тяжелых металлов основа. Именно поэтому бесполезно осушать водохранилища, которые активно строились в СССР в эпоху гидроэлектростанций — использовать отравленные земли уже не получится.
Но и это еще не все. Нерастворимые соединения могут вступить в химические реакции и превратиться в растворимые, которые накапливаются растениями.
Их адсорбируют и травы, и деревья, а еще активнее это делают водоросли. Ионы металлов проходят через мембрану клетки, усваиваются растениями в процессе метаболизма. На этот факт стоит обратить внимание всем, кто любит очищать организм от тяжелых металлов, поедая сухие водоросли.
Прежде чем питаться ими, следует поинтересоваться составом атмосферы в том месте, где водоросли собирали. Чтобы не оказалось, что “пылесос”, который должен чистить организм, уже забит до предела.
Снижение агрессивной среды для предотвращения металлических изделий от коррозии
На современных производственных предприятиях могут успешно применяться способы защиты металлических изделий от коррозии, основанные на модификации состава агрессивной среды, в которой работают детали из металла. Существует 2 способа снижения агрессивности среды:
- внедрение ингибиторов (веществ, замедляющих процесс коррозии металлических изделий);
- устранение из рабочей среды соединений, провоцирующих коррозионные процессы.
Первый способ часто применяется для охлаждающих систем, емкостей, травильных ванн и других объектов с постоянным объемом коррозионных сред.
Существует несколько разновидностей замедлителей коррозии:
- органические, неорганические, летучие;
- анодные, катодные, комбинированные;
- вещества для щелочных, кислых или нейтральных сред.
Действующие требования СНиП допускают использование следующих ингибиторов:
- Ca(HCO3)2;
- бораты и полифосфаты;
- бихроматы и хроматы;
- нитриты;
- органические вещества (многоосновные спирты, тиолы, амины, аминоспирты, аминокислоты с поликарбоксильными свойствами, летучие составы «ИФХАН-8А», «ВНХ-Л-20», «НДА»).
В свою очередь для снижения агрессивности коррозионных сред применяют такие способы, как:
- вакуумирование;
- нейтрализация кислотных соединений каустической содой или гашеной известью;
- деаэрация с последующим удалением кислорода.
В настоящее время существует широкий выбор технологий для защиты металлических деталей от коррозии. В каждом отдельном случае необходимо только выбрать оптимальный вариант обработки, чтобы обеспечить максимально высокий срок службы изделиям из сталей и чугуна.