Ущерб, наносимый подобным процессом, огромен. Иногда стоимость принесенного им вреда во много раз превышает затраты на производство самого металла и на последующее использование деталей из него. По данным мировой статистики каждая шестая доменная печь в мире работает на то, чтобы покрыть последствия этого явления.
Коррозия — это процесс естественного разрушения металла под воздействием факторов среды, в которой он находится. Само название явления взято из латинского языка. «Коррозио» значит «разъедание».
Скорость электрохимической коррозии.
Термодинамика устанавливает возможность
протекания процесса коррозии, но не дает реальных представлений о скорости коррозии.
2) Глубинный показатель,Кг — уменьшение толщины металла в единицу времени, [мм/год].
Для пересчета единиц есть таблицы.
По скорости коррозии 3 группы металлов:
а) 1,5 мм/год – не стойкие, не используются в коррозионной среде.
3) Плотность коррозионного тока (или ток коррозии),i
кор (
Iкор
) — величина тока, приходящегося на единицу площади металла, растворенного в единицу времени.
По закону Фарадея: iкор = m F/Mэ S t,
где М
Э — молярная масса эквивалента металла, г/моль;
F – число Фарадея, 96500 кл/моль;
i
кор — плотность коррозионного тока, А/м 2 ;
Кm, Кг, iкор — прямые показатели коррозии.
Екор
— стационарный потенциал корродирующего металла (устанавливается на поверхности металла), при котором протекают сопряженные реакции ионизации Ме и восстановления Ох.
для Fe
скорость коррозии:
Км
= 1г/(м 2 ×сут) и
i
корр=0,04А/м 2
При работе КГЭ имеет место поляризация, приводящая к понижению ЭДС и понижению V коррозии. Скорость электрохимической коррозии зависит от скорости лимитирующей стадии: V=Vлим.ст. (анодное растворение М; катодное поглощение О2 – наиболее часто; катодное выделение Н2). Чтобы ↓V нужно ↓Vлим.ст., т.е. ↑ поляризацию. Поляризационные кривые коррозионного микроэлемента – коррозионные диаграммы.
Дата добавления: 2014-12-03 ; ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник
Долговечность металлической винтовой сваи с учетом коррозионных процессов в грунте
Одним из наиболее существенных вопросов, возникающих при применении металлических конструкций в строительстве, является вопрос сопротивления таких конструкций процессам коррозии и связанная с ним долговечность зданий и сооружений.
В настоящее время существует комплекс взаимоувязанных межгосударственных стандартов, устанавливающих общие требования, правила, нормы и методы защиты изделий, конструкций и материалов от коррозии, старения и биоповреждений на всех стадиях жизненного цикла изделий и конструкций исследование и обоснование разработки (Стандарты ЕСЗКС – Единая система защиты от коррозии и старения материалов и изделий) [1, 2, 3, 4].
Назначение ЕСЗКС – обеспечение и сохранение заданного уровня качества изделий, конструкций и материалов средствами и методами защиты от коррозии, старения и биоповреждений с учетом требований безопасности, экологии, совместимости и взаимозаменяемости, а также конкурентной способности изделий и конструкций на мировом рынке.
Помимо стандартов ЕСЗКС, требования к коррозионной стойкости устанавливаются также нормативами на отдельные виды конструкций и их частей в зависимости от действующих коррозионных факторов.
Для подземных сооружений (в т.ч. фундаментов), критериями опасности коррозии являются [5]:
- коррозионная агрессивность среды ( грунтов , грунтовых и других вод) по отношению к металлу сооружения (включая биокоррозионную агрессивность грунтов );
- опасное действие блуждающего постоянного и переменного токов.
Исходя из этих критериев, следует, что скорость коррозии металла в грунте зависит от:
- pH грунта
. Чем ниже pH (кислая среда), тем скорость коррозии выше. - электрического сопротивления грунта
. Чем выше сопротивление грунта, тем скорость коррозии медленнее.
Также необходимо учитывать наличие антикоррозионного покрытия, препятствующего коррозии.
Исследования по определению электрического сопротивления грунта с учетом возможного повышения влажности и изменения температуры проводились Американским Федеральным дорожным агентством (Federal Highway Administration – FHWA) и отражены в руководстве для инженеров транспорта [6, Table N-1] (табл.1).
Representative values of soil resistivity
Электрические сопротивления грунтов
Таблица 1
| Soil Type Тип грунта | Resistivity ρ(Ωm) Сопротивление, Ом |
| Clay, saturated silt Глина | 100 |
| Sandy or silty clay Суглинок | 250 |
| Clayey sand or saturated sand Супесь | 500 |
| Sand Песок | 1500 |
| Gravel Обломочный грунт | 5000 |
| Dry sand, rock Скальный грунт | >5000 |
Определение pH грунтов возможно на основе исследований Американского института стали и сплавов (American Iron and Steel Institute – AISI), согласно которым значение pH грунтов составляет от 6,5 до 8.
Таким образом, зная показатели электрического сопротивления и pH грунта , возможно прогнозирование срока службы металлической винтовой сваи для заданных грунтовых условий.
Ориентировочные данные по скорости коррозии металлов в различных типах грунтов также имеются в зарубежных нормах проектирования [7] (табл. 2).
Скорость коррозии стали в грунте
Таблица 2
| Corrosion Rate, mm/yr (10-6 m/yr) Скорость коррозии, мм/год (10-6 м/год) | Soil Type with or without groundwater (interpretation) Тип грунта (с наличием или отсутствием грунтовых вод) |
| 0.012 mm/yr (12∙10-6 m/yr) | Undisturbed natural soils(sand, silt, clay, schist) < сланцевые глина, отложения, илистые (песок, структуры ненарушенной> |
| 0.030 mm/yr (30∙10-6 μm/yr) | Undisturbed natural soils(sand, silt, clay, schist) Грунт ненарушенной структуры (песок, илистые отложения, глина, сланцевые отложения) |
| 0.030 mm/yr (30∙10-6 μm/yr) | Aggressive natural soils (swamp, peat, marsh) Агрессивные грунты (торф, болото) |
| 0.020 mm/yr (20∙10-6 μm/yr) | Non-compacted & non-aggressive fills (sand, silt, clay, schist) Песок, илистые отложения, глина, сланцевые отложения |
| 0.050 mm/yr (50∙10-6 μm/yr) | Non-compacted aggressive fills (ashes, slags) Зола, шлаки |
В качестве примера определения срока службы металлической винтовой сваи рассмотрим свайный фундамент, устраиваемый под конструкцию пола Грановитой Палаты Московского Кремля компанией ФУНДЭКС.
- Свая имеет защитное антикоррозионное покрытиена основе эпоксидных композиций. Покрытие сваи обладает повышенной стойкостью к почвенной коррозии. Срок службы данного покрытия согласно ЕСЗКС составляет 50 лет.
- Произведем расчет стали при действии коррозионных процессов.
Скорость коррозии согласно [7] составляет для техногенных грунтов составляет ок. 0.030 мм/год. При условии толщины стали лопасти 5 мм срок коррозии составит от 5/0.030 = 166, 66 лет.
С учетом сроков разрушения защитного покрытия расчетный срок службы сваи по скорости коррозии лопасти составляет для данного типа грунтовой обстановки не менее 200 лет.
Библиографический указатель
- ГОСТ 9.101-2002 ЕСЗКС. Основные положения.
- ГОСТ 9.102-91 ЕСЗКС. Воздействие биологических факторов на технические объекты. Термины и определения.
- ГОСТ 9.103-78 ЕСЗКС. Временная противокоррозионная защита металлов и изделий. Термины и определения.
- ГОСТ 9.306-85 ЕСЗКС. Покрытия металлические и неметаллические неорганические. Обозначения.
- ГОСТ 9.602-2005 «СООРУЖЕНИЯ ПОДЗЕМНЫЕ Общие требования к защите от коррозии»
- Traffic Detector Handbook: Third Edition—Volume II. Publication No. FHWA-HRT-06-139
- EN 1993-5:2007. Еврокод 3. Проектирование стальных конструкций. Часть 5. Свайные сооружения.
Учебно-методическое пособие «Защита материалов от коррозии» , страница 21
Испытания на МКК и коррозионное растрескивание
Эти испытания проводят для аустенитных, аустенитно-ферритных и аустенитно-мартенситных нержавеющих сталей на образцах в растворах CuSO4×5H2O и H2SO4 с добавлением медной стружки и цинковой пыли. После кипячения в течение регламентированного времени от 7 до 48 часов проводят изгиб образцов для определения сетки трещин, являющейся браковочным признаком. Определение глубины проникновения МКК проводят на поперечном шлифе с помощью микроскопа.
Испытание на растрескивание проводят на испытательных машинах или установках, позволяющих определить уровень безопасных напряжений, время появления первой трещины, характер коррозионных разрушений.
Показатели коррозии
Показатели коррозии характеризуют в общем случае степень проявления различных изменений в материалах в результате коррозионных воздействий.
Кинетика электрохимических процессов
Скорость коррозии также можно определить количеством растворившегося металла, которое согласно закону Фарадея пропорционально количеству электричества.
Dm = Q×m Э /F = i×S×t×m Э /F = i×S×t×K,
где Q – количество электричества; Dm – уменьшение массы; F – число Фарадея, К – электрохимический эквивалент, K = m Э /F; S – площадь электрода; m Э – эквивалентная масса, m Э = A/n, A – атомная масса, n — степень окисления.
Другие показатели коррозии
1. Глубинный показатель коррозии:
kn = P/t,
мм/год.
P — средняя глубина коррозионного разрушения в единицу времени.
2. Показатель скорости образования пленки продуктов коррозии:
kh = Dh/t,
мм/год
:
3. Показатель изменения массы:
km — , km + — изменение массы образца металла в результате коррозии, отнесенное к единице поверхности S металла в единицу времени: km ± = Dm/(S×t),
г/м 2 ч,
Dm — увеличение, или убыль массы образца металла за время t после удаления продуктов коррозии. Формула пересчета km — в глубинный показатель: kn = km — ×8.76/r
мет
,
мм/ год
.
4. Объемный показатель коррозии
: kоб = V(ну)/(S×t),
cм 3 / см 2 ч
где V(ну) = V×273×(P – PH2O)/(T×760); V – объем поглощенного О2 в процессе коррозии с кислородной деполяризацией или объем выделившегося водорода в процессе коррозии с водородной деполяризацией.
5. Токовый показатель коррозии:
(
— плотность коррозионного тока) iкор = Jкор/S, А/см 2 ,
Jкор — ток коррозии,
А
Формула пересчета km — в токовый показатель: iкор = km — ×/(k Э ×1000), А/см 2
k Э — электрохимический эквивалент металла, k Э = A/(n×F), А – атомная масса металла,
г/моль,
n – валентность металла, подвергающегося коррозии, F – число Фарадея, F = 26.8
А×ч.
Формула пересчета объемного показателя коррозии в токовый iкор
= kоб/k Э ,
А/ см 2
, k Э — электрохимический эквивалент элемента, k Э Н2 = (22.4×10 3 /2)/26.8,
см 3 /(А×ч);
k Э O2 =(22.4×10 3 /4)/26.8,
см 3 /(А×ч).
6. Механический показатель коррозии
: ks = Dsb/sb×100% sb — предел прочности металла при растяжении до начала коррозии; Dsb — изменение предела прочности металла в процессе коррозии за время t.
7. Показатель изменения электрического сопротивления
: kR = DR/R×100%, R – электрическое сопротивление образца до начала коррозии; DR — изменение электрического сопротивления металлического образца в процессе коррозии за время t.
8. Очаговый показатель коррозии
: kО — число коррозионных очагов, возникающих на единице металлической поверхности за определенный промежуток времени эксплуатации изделий.
9. Показатель склонности к коррозии
: kС – срок эксплуатации (испытания) до начала коррозионного процесса t в сутках. Начало коррозионного процесса определяют состоянием поверхности металла, при котором коррозионное поражение достигло 1% площади.
Коррозия
Применительно к терминам, коррозия есть разрушение металла, вызванное химическими и электрохимическими процессами, развивающимися на поверхности металла при его взаимодействии с внешней средой. Разрушению от коррозии подвержены и другие материалы, такие как бетон, строительный камень, дерево, коррозия полимеров в свою очередь называется деструкцией, но эта тема требует отдельного разговора. Наиболее знакомый вид коррозии это ржавление железа. Эрозия есть воздействие на металл таких факторов внешней среды как дождь, ветер, пыль, именно поэтому металлические арки, металлические конструкции мостов, металлические фермы, опоры и другие сооружения, где основные несущие конструкции сделаны из металла надо защищать комплексно.
Стандарты, по которым работают производители металла, основные термины касаемо самого металла и его сплавов регламентируются и прописаны в международном стандарте ISO. Вот как означает коррозия по стандарту ISO 8044 – «коррозия это физико-химическое или химическое взаимодействие между металлом (сплавом) и средой, приводящее к ухудшению функциональных свойств металла (сплава), среды или включающей их технической системы».
Чтобы понять механизмы возникновения коррозии металла и методы предотвращения коррозии, необходимо в первую очередь рассмотреть среду, в которой металл подвергается коррозии «корродирует», такая среда называется коррозионной или агрессивной средой (см. Приложение №1). В случае с металлами, когда говоря об их коррозии, имеют в виду нежелательный процесс взаимодействия металла со средой. Физико-химическая сущность изменений, которые претерпевает металл при коррозии, является окисление металла. Любой коррозионный процесс является многостадийным: Необходим контакт коррозионной среды или отдельных ее компонентов с поверхностью металла. Известно, что большинство металлов (кроме Ag, Pt ,Cu, Au) встречаются в природе в ионном состоянии: оксиды, сульфиды, карбонаты и др., называемые обычно рудами металлов. Ионное состояние более выгодно, оно характеризуется меньшей внутренней энергией. Это заметно при получении металлов из руд и их коррозии. Поглощенная энергия при восстановлении металла из соединений свидетельствует о том, что свободный металл обладает более высокой энергией, чем металлическое соединение. Это приводит к тому, что металл, находящийся в контакте с коррозионно-активной средой стремится перейти в энергетически выгодное состояние с меньшим запасом энергии. То есть можно сказать, что первопричиной коррозии является термодинамическая неустойчивость системы, состоящей из металла и компонентов окружающей (коррозионной) среды. Мерой термодинамической неустойчивости является свободная энергия, освобождаемая при взаимодействии металла с этими компонентами. Но свободная энергия сама по себе ещё не определяет скорость коррозионного процесса, т. е. величину, наиболее важную для оценки коррозионной стойкости металла. В ряде случаев адсорбционные или фазовые слои (плёнки), возникающие на поверхности металла в результате начавшегося коррозионного процесса образуют настолько плотный и непроницаемый барьер, что коррозия прекращается или очень сильно тормозится. Поэтому в условиях эксплуатации металл, обладающий большим сродством к кислороду, может оказаться не менее, а более стойким (так, свободная энергия образования окисла у Cr или Al выше, чем у Fe, а по стойкости они часто превосходят Fe).
Ниже приведены фотографии к стандарту ISO 8501-1, в соответствии с которым производится оценка степени коррозии. Оценка первоначального состояния поверхности производится с целью определения возможной и/или необходимой степени очистки, а также выбора оптимального метода подготовки поверхности.
Оценке подлежат: СТЕПЕНЬ КОРРОЗИИ, НАЛИЧИЕ ДЕФЕКТОВ, НАЛИЧИЕ ЖИРОВЫХ И МАСЛЯНЫХ ЗАГРЯЗНЕНИЙ.
A. Поверхность стали, покрытая в большей степени прочно прилегающей прокатной окалиной, но практически без ржавчины.
B. Поверхность стали, начавшая ржаветь, и с которой начинает отставать прокатная окалина.
C. Поверхность стали, с которой прокатная окалина исчезла в результате ржавления или с которой она может быть удалена, на которой наблюдаются отдельные коррозионные повреждения при обычном рассмотрении.
D. Поверхность стали, с которой прокатная окалина исчезла в результате ржавления и на которой наблюдается общая коррозия при обычном рассмотрении
Приложение №1
Категории коррозии при атмосферных условиях окружающей среды по стандарту ISO 12944-2 и ISO 9223.
| Потеря массы и толщины цинкового покрытия за год эксплуатации | Типичные примеры для умеренного климата | |||
| степень | потеря массы г/м² | уменьшение толщины, мкм | снаружи | внутри |
| С1 незначительная | ≤ 0,7 | ≤ 0,1 | – | Обогреваемые здания с нейтраль-ной атмосферой, например: офисы, магазины, школы, гостиницы. |
| С2 слабая | > 0,7-5 | > 0,1-0,7 | Атмосфера с незначительным загрязнением. В основном сельские районы. | Неотапливаемые здания, где выступает конденсация, например: склады, спортзалы. |
| С3 умеренная | > 5-15 | > 0,7-2,1 | Атмосфера города и промышленных зон. Умеренное загрязнение двуокисью серы. | Производственные помещения с высокой влажностью и слабым загрязнением воздуха, например: по производству продуктов питания, прачечные, пивоварни, молокозаводы. |
| С4 сильная | > 15-30 | > 2,1-4,2 | Промышленные районы и побережье с умеренной концентрацией солей. | Химические сооружения, бассейны, домики над водой. |
| С5-I очень сильная (промышленная) | > 30-60 | > 4,2-8,4 | Промышленные районы с высокой влажностью и агрессивной атмосферой. | Здания или зоны с почти постоянной конденсацией и сильным загрязнением. |
| C5-M очень сильная (море) | > 30-60 | > 4,2-8,4 | Прибрежные зоны с высокой концентрацией солей. | Здания или зоны с почти постоянной конденсацией и сильным загрязнением. |
| Примечание: в прибрежных районах с теплым влажным климатом потери массы или снижение толщины могут превышать границы категории С5-М. | ||||
Лабораторная работа №1. Коррозия металлов.
Цель работы:
Изучить влияние изменения условий на протекание коррозии.
Коррозией металлов называют разрушение металлических материалов вследствие химического или электрохимического взаимодействия их с внешней средой. Пример электрохимической коррозии: коррозия металлов в атмосфере при конденсации влаги на металлической поверхности (около 80% металлических конструкций эксплуатируются в атмосферных условиях — транспорт, оборудование заводов, мосты, рельсы и т.д.), коррозия различных трубопроводов в грунте, коррозия металлов в морской и речной воде и т.д.
- АлтГТУ 419
- АлтГУ 113
- АмПГУ 296
- АГТУ 267
- БИТТУ 794
- БГТУ «Военмех» 1191
- БГМУ 172
- БГТУ 603
- БГУ 155
- БГУИР 391
- БелГУТ 4908
- БГЭУ 963
- БНТУ 1070
- БТЭУ ПК 689
- БрГУ 179
- ВНТУ 120
- ВГУЭС 426
- ВлГУ 645
- ВМедА 611
- ВолгГТУ 235
- ВНУ им. Даля 166
- ВЗФЭИ 245
- ВятГСХА 101
- ВятГГУ 139
- ВятГУ 559
- ГГДСК 171
- ГомГМК 501
- ГГМУ 1966
- ГГТУ им. Сухого 4467
- ГГУ им. Скорины 1590
- ГМА им. Макарова 299
- ДГПУ 159
- ДальГАУ 279
- ДВГГУ 134
- ДВГМУ 408
- ДВГТУ 936
- ДВГУПС 305
- ДВФУ 949
- ДонГТУ 498
- ДИТМ МНТУ 109
- ИвГМА 488
- ИГХТУ 131
- ИжГТУ 145
- КемГППК 171
- КемГУ 508
- КГМТУ 270
- КировАТ 147
- КГКСЭП 407
- КГТА им. Дегтярева 174
- КнАГТУ 2910
- КрасГАУ 345
- КрасГМУ 629
- КГПУ им. Астафьева 133
- КГТУ (СФУ) 567
- КГТЭИ (СФУ) 112
- КПК №2 177
- КубГТУ 138
- КубГУ 109
- КузГПА 182
- КузГТУ 789
- МГТУ им. Носова 369
- МГЭУ им. Сахарова 232
- МГЭК 249
- МГПУ 165
- МАИ 144
- МАДИ 151
- МГИУ 1179
- МГОУ 121
- МГСУ 331
- МГУ 273
- МГУКИ 101
- МГУПИ 225
- МГУПС (МИИТ) 637
- МГУТУ 122
- МТУСИ 179
- ХАИ 656
- ТПУ 455
- НИУ МЭИ 640
- НМСУ «Горный» 1701
- ХПИ 1534
- НТУУ «КПИ» 213
- НУК им. Макарова 543
- НВ 1001
- НГАВТ 362
- НГАУ 411
- НГАСУ 817
- НГМУ 665
- НГПУ 214
- НГТУ 4610
- НГУ 1993
- НГУЭУ 499
- НИИ 201
- ОмГТУ 302
- ОмГУПС 230
- СПбПК №4 115
- ПГУПС 2489
- ПГПУ им. Короленко 296
- ПНТУ им. Кондратюка 120
- РАНХиГС 190
- РОАТ МИИТ 608
- РТА 245
- РГГМУ 117
- РГПУ им. Герцена 123
- РГППУ 142
- РГСУ 162
- «МАТИ» — РГТУ 121
- РГУНиГ 260
- РЭУ им. Плеханова 123
- РГАТУ им. Соловьёва 219
- РязГМУ 125
- РГРТУ 666
- СамГТУ 131
- СПбГАСУ 315
- ИНЖЭКОН 328
- СПбГИПСР 136
- СПбГЛТУ им. Кирова 227
- СПбГМТУ 143
- СПбГПМУ 146
- СПбГПУ 1599
- СПбГТИ (ТУ) 293
- СПбГТУРП 236
- СПбГУ 578
- ГУАП 524
- СПбГУНиПТ 291
- СПбГУПТД 438
- СПбГУСЭ 226
- СПбГУТ 194
- СПГУТД 151
- СПбГУЭФ 145
- СПбГЭТУ «ЛЭТИ» 379
- ПИМаш 247
- НИУ ИТМО 531
- СГТУ им. Гагарина 114
- СахГУ 278
- СЗТУ 484
- СибАГС 249
- СибГАУ 462
- СибГИУ 1654
- СибГТУ 946
- СГУПС 1473
- СибГУТИ 2083
- СибУПК 377
- СФУ 2424
- СНАУ 567
- СумГУ 768
- ТРТУ 149
- ТОГУ 551
- ТГЭУ 325
- ТГУ (Томск) 276
- ТГПУ 181
- ТулГУ 553
- УкрГАЖТ 234
- УлГТУ 536
- УИПКПРО 123
- УрГПУ 195
- УГТУ-УПИ 758
- УГНТУ 570
- УГТУ 134
- ХГАЭП 138
- ХГАФК 110
- ХНАГХ 407
- ХНУВД 512
- ХНУ им. Каразина 305
- ХНУРЭ 325
- ХНЭУ 495
- ЦПУ 157
- ЧитГУ 220
- ЮУрГУ 309
Основные закономерности протекания атмосферной коррозии
Атмосферная коррозия — наиболее распространенный вид коррозии металлов, протекающей во влажной воздушной среде: примерно 80% металлических конструкций, зданий, сооружений, мостов, машин и т.п. эксплуатируются в атмосферных условиях. Отличительной особенностью атмосферной коррозии является то, что она протекает не в объеме электролита, а в тонких пленках. При этом коррозионный процесс протекает по законам электрохимической кинетики, но имеет свои специфические особенности.
Основными факторами, влияющими на скорость протекания атмосферной коррозии, являются:
- влажность атмосферы;
- химический состав атмосферы;
- длительность периодов увлажнения и высыхания пленок влаги.
Рис. 1. Основные коррозионно опасные примеси в атмосфере
Рассмотрим подробнее механизм влияния вышеуказанных факторов на интенсивность коррозионного разрушения.
Влажность атмосферы
В воздухе всегда содержится некоторое количество водяного пара. Влажность воздуха обычно численно описывается следующими факторами:
- абсолютная влажность (количество пара), г/м3;
- давление водяного пара, атм (Па);
- относительная влажность, (φ), рассчитываемая, как (Р/Рнас)·100%, где Р — давление водяного пара, находящегося в воздухе; Рнас — давление насыщенного водяного пара, находящегося при данной температуре.
В соответствии с показателями влажности воздуха, атмосферная коррозия может быть классифицирована следующим образом:
- сухая атмосферная коррозия;
- влажная атмосферная коррозия;
- мокрая атмосферная коррозия.
Сухая атмосферная коррозия
протекает в очень тонких пленках (до 10 нм) при влажности воздуха 30-50% и характеризуется поверхностным окислением металла по химическому механизму с образованием соответствующих оксидов (явление «потускнения» металла). Как правило, не приводит к серьезным коррозионным разрушениям.
Влажная атмосферная коррозия
начинается обычно при относительной влажности воздуха выше 70%. При этой влажности, называемой критической, происходит капиллярная конденсация влаги и вода начинает проявлять свойства электролита. Капиллярную конденсацию могут стимулировать шероховатость поверхности, различные неровности, загрязнения металла твердыми частицами (пыль) и т.п. Толщина формирующихся на металле пленок влаги составляет от 0,01 до 1 мкм и в этих условиях к поверхности металла происходит очень интенсивное поступление кислорода, что приводит к ускорению коррозионного процесса по сравнению с объемом электролита. Механизм протекания процесса влажной атмосферной коррозии показан на рис. 2.
Рис. 2. Влажная атмосферная коррозия
Критическая влажность может снижаться из-за присутствия на поверхности металла загрязнений (естественных или антропогенных), которые притягивают влагу из воздуха. Например, частицы солей аммония, адсорбированные стальной поверхностью, существенно уменьшают критическую влажность с 70-80% до 50% (см. рис. 3). Также критическую влажность понижают образующиеся на поверхности металла продукты коррозии (особенно продукты коррозии стали), что, в конечном счете, приводит к ускорению коррозионных процессов.
Рис. 3. Влияние загрязнений на капиллярную конденсацию влаги на поверхности металла
Мокрая атмосферная коррозия протекает при толщинах пленки влаги на металлической поверхности от 1 до 1000 мкм. Процесс коррозии несколько замедляется по сравнению с влажной атмосферной коррозией вследствие затрудненности диффузии кислорода к поверхности металла и более сходен с обычной электрохимической коррозией.
Химический состав атмосферы
Коррозионная агрессивность атмосферы определяется не только влажностью, но и различными химическими веществами: твердыми и газообразными. В воздухе содержатся различные газы биогенного, природного и антропогенного происхождения (SO2, SO3,NO2, N2O3, N2O5, H2S, Cl2 и др.), а также частицы твердых веществ (хлориды, сульфаты, силикаты, частицы пыли и др.) (рис. 1). Все эти вещества, могут растворяться в пленках конденсированной влаги, увеличивая ее коррозионную агрессивность. Наиболее опасными в коррозионном отношении газами являются SO2 и SO3, образующие с парами воды в атмосфере аэрозоли сернистой и серной кислот. В общем виде классификация коррозионной агрессивности атмосферных сред приводится в следующих стандартах:
- ISO 9223: «Коррозия металлов и сплавов. Коррозионная активность атмосферы. Классификация»;
- ISO 12944: «Лаки и краски. Защита стальных конструкций от коррозии защитными окрасочными системами».
Длительность периодов увлажнения и высыхания пленок влаги
Конструкции в открытой атмосфере подвержены воздействию осадков, агрессивных газов, аэрозолей и других факторов. Общую продолжительность нахождения пленки влаги на поверхности металла определяют как суммарную продолжительность выпадения дождя и росы, воздействия тумана и оттепелей в зимний период, а также длительность высыхания поверхности. При толщине пленок влаги более 30 мкм (мокрая коррозия), скорость коррозионного процесса определяется скоростью испарения влаги, времени и частотой повторного смачивания. Скорость испарения зависит, в свою очередь, от относительной влажности φ, температуры, интенсивности воздухообмена.
Следует отметить, что процессы смачивания металла могут уменьшать общую скорость атмосферной коррозии металла за счет смывания коррозионно-активных адсорбционных пленок и отчистки поверхности металла от пыли и твердых солей.
Хотите узнать больше о коррозии металлических конструкций и методах противокоррозионной защиты?
Скачайте наше специализированное учебно-справочное приложение «Защита от коррозии»
Скорость коррозии металлов. Методы оценки коррозионных процессов
Скорость коррозии – многофакторный параметр, который зависит как от внешних условий среды, так и от внутренних свойств материала. В нормативно-технической документации существуют определенные ограничения по допустимым значениям разрушения металла при эксплуатации оборудования и строительных конструкций для обеспечения их безаварийной работы. В проектировании не существует универсального метода определения скорости коррозии. Это связано со сложностью учета всех факторов. Наиболее надежным методом является изучение истории эксплуатации объекта.
Критерии
Вам будет интересно: Процессы изобарный, изохорный, изотермический и адиабатный для идеального газа
В настоящее время в проектировании техники используют несколько показателей скорости коррозии:
- По прямому способу оценки: уменьшение массы металлической детали на единицу поверхности – весовой показатель (измеряется в граммах на 1 м2 за 1 час); глубина повреждений (или проницаемость коррозионного процесса), мм/год; количество выделяющейся газовой фазы продуктов коррозии; продолжительность времени, в течение которого появляется первое коррозионное повреждение; число центров коррозии на единицу площади поверхности, появившихся за определенный срок.
- По косвенной оценке: сила тока электрохимической коррозии; электрическое сопротивление; изменение физико-механических характеристик.
Первый показатель по прямому методу оценки является наиболее распространенным.
Расчетные формулы
В общем случае весовые потери, определяющие скорость коррозии металла, находят по следующей формуле:
где q – уменьшение массы металла, г;
S – площадь поверхности, с которой произошел перенос материала, м2;
t – период времени, ч.
Для листового проката и изготовленных из него обечаек определяют глубинный показатель (мм/год):
m – глубина проникновения коррозии в металл.
Между первым и вторым показателями, описанными выше, существует следующая зависимость:
где ρ – плотность материала.
Основные факторы, влияющие на скорость коррозии
На скорость разрушения металла влияют следующие группы факторов:
- внутренние, связанные с физико-химической природой материала (фазовая структура, химический состав, шероховатость поверхности детали, остаточные и рабочие напряжения в материале и другие);
- внешние (окружающие условия, скорость движения коррозионно-активной среды, температура, состав атмосферы, наличие ингибиторов или стимуляторов и другие);
- механические (развитие коррозионных трещин, разрушение металла под действием циклических нагрузок, кавитационная и фреттинг-коррозия);
- конструктивные особенности (выбор марки металла, наличие зазоров между деталями, требования к шероховатости).
2.Классификация коррозии
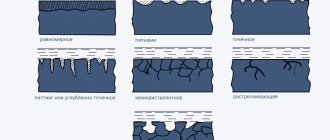
2.1.Виды коррозии. Классификация по виду, геометрическому характеру коррозионных разрушений на поверхности или в объёме металла.
Коррозию, захватившую всю поверхность металла, называют сплошной. Сплошную коррозию делят на равномерную и неравномерную, в зависимости от глубины коррозионного разрушения на разных участках. При местной коррозии поражения локальны и оставляют практически незатронутой значительную (иногда подавляющую) часть поверхности. В зависимости от степени локализации различают коррозионные пятна, язвы и точки. Точечные поражения могут дать начало под поверхностной коррозии, распространяющейся в стороны под очень тонким (например, наклёпанным) слоем металла, который затем вздувается пузырями или шелушится. Наиболее опасные виды местной коррозии – межкристаллитная (интеркристаллитная), которая, не разрушая зёрен металла, продвигается вглубь по их менее стойким границам, и транскристаллитная, рассекающая металл трещиной прямо через зёрна. Почти не оставляя видимых следов на поверхности, эти поражения могут приводить к полной потере прочности и разрушению детали или конструкции. Близка к ним по характеру ножевая коррозия, словно ножом разрезающая металл вдоль сварного шва при эксплуатации некоторых сплавов в особо агрессивных растворах. Иногда специально выделяют поверхностную нитевидную коррозию, развивающуюся, например, под неметаллическими покрытиями, и послойную коррозию, идущую преимущественно в направлении пластической деформации. Специфична избирательная коррозия, при которой в сплаве могут избирательно растворяться даже отдельные компоненты твёрдых растворов (например, обесцинкование латуней).
2.2 Классификация коррозии по механизму реакций взаимодействия металла со средой (химическая и электрохимическая коррозия).
Коррозия является химической, если после разрыва металлической связи атомы металла непосредственно соединяются химической связью с теми атомами или группами атомов, которые входят в состав окислителей, отнимающих валентные электроны металла. Химическая коррозия возможна в любой коррозионной среде, однако чаще всего она наблюдается в тех случаях, когда коррозионная среда не является электролитом (газовая коррозия, коррозия в неэлектропроводных органических жидкостях). Скорость химической коррозии чаще всего определяется диффузией частиц металла и окислителя через поверхностную плёнку продуктов коррозии (высокотемпературное окисление большинства металлов газами), иногда – растворением или испарением этой плёнки (высокотемпературное окисление W или Mo), её растрескиванием (окисление Nb при высоких температурах) и изредка – конвективной доставкой окислителя из внешней среды (при очень малых его концентрациях). Коррозия является электрохимической, если при выходе из металлической решётки образующийся катион вступает в связь не с окислителем, а с другими компонентами коррозионной среды; окислителю же передаются электроны, освобождающиеся при образовании катиона. Такой процесс возможен в тех случаях, когда в окружающей среде существуют два типа реагентов, из которых одни (сольватирующие или комплексообразующие) способны соединяться устойчивыми связями с катионом металла без участия его валентных электронов, а другие (окислители) могут присоединять валентные электроны металла, не удерживая около себя катионы. Подобными свойствами обладают растворы или расплавы электролитов, где сольватированные катионы сохраняют значительную подвижность. Таким образом, при электрохимической коррозии удаление атома из металлической решётки (что составляет суть любого коррозионного процесса) осуществляется в результате двух независимых, но сопряжённых, связанных между собой электрическим балансом, электрохимических процессов: анодного – переход сольватируемых катионов металла в раствор, и катодного – связывание окислителем освобождающихся электронов. Отсюда следует, что процесс электрохимической коррозии можно замедлить не только путём непосредственного торможения анодного процесса, но также воздействуя на скорость катодного. Наиболее распространены два катодных процесса: разряд водородных ионов (2е + 2H+ = H2) и восстановление растворённого кислорода (4е + O2 + 4H+ = 2H2O или 4е + O2 + 2H2O = 4ОН-), которые часто называют соответственно водородной и кислородной деполяризацией. Анодный и катодный процессы с той или иной вероятностью и в той или иной последовательности протекают в любых точках металлической поверхности, где катионы и электроны могут взаимодействовать с компонентами коррозионной среды. Если поверхность однородна, то катодные и анодные процессы равновероятны по всей её площади; в таком идеальном случае коррозию называют гомогенно-электрохимической (отмечая, таким образом, отсутствие какой-либо неоднородности в распределении вероятности электрохимических процессов в любой точке поверхности, что, конечно, не исключает термодинамической гетерогенности взаимодействующих фаз). В действительности на металлических поверхностях существуют участки с различными условиями доставки реагирующих компонентов, с разным энергетическим состоянием атомов или с различными примесями. На таких участках возможно более энергичное протекание либо анодного, либо катодного процессов, и коррозия становится гетерогенно-электрохимической.
2.3. Классификация коррозии по типу коррозионной среды
Некоторые коррозионные среды и вызываемые ими разрушения столь характерны, что по названию этих сред классифицируются и протекающие в них коррозионные процессы. Как правило, металлические изделия и конструкции подвергаются действию многих видов коррозии – в этих случаях говорят о действии так называемой смешанной коррозии. Газовая коррозия – коррозия в газовой среде при высоких температурах. Атмосферная коррозия – коррозия металла в условиях атмосферы при влажности, достаточной для образования на поверхности металла пленки электролита (особенно в присутствии агрессивных газов или аэрозолей кислот, солей и т.д.). Особенностью атмосферной коррозии является сильная зависимость ее скорости и механизма от толщины слоя влаги на поверхности металла или степени увлажнения образовавшихся продуктов коррозии. Жидкостная коррозия – коррозия в жидких средах. По условиям воздействия жидкой среды на металл этот тип коррозии также характеризуется как коррозия при полном погружении, при неполном погружении, при переменном погружении, имеющие свои характерные особенности. Подземная коррозия – коррозия металла в грунтах и почвах. Характерной особенностью подземной коррозии является большое различие в скорости доставки кислорода (основной деполяризатор) к поверхности подземных конструкций в разных почвах (в десятки тысяч раз).
2.4. Классификация коррозии по характеру дополнительных воздействий
Коррозия под напряжением развивается в зоне действия растягивающих или изгибающих механических нагрузок, а также остаточных деформаций или термических напряжений. Коррозия под напряжением как правило, ведёт к транскристаллитному коррозионному растрескиванию, которому подвержены, например, стальные тросы и пружины в атмосферных условиях, углеродистые и нержавеющие стали в паросиловых установках, высокопрочные титановые сплавы в морской воде и т. д. При знакопеременных нагрузках может проявляться коррозионная усталость, выражающаяся в более или менее резком понижении предела усталости металла в присутствии коррозионной среды. Коррозионная эрозия (или коррозия при трении) представляет собой ускоренный износ металла при одновременном воздействии взаимно усиливающих друг друга коррозионных и абразивных факторов (трение скольжения, поток абразивных частиц и т. п.). Родственная ей кавитационная коррозия возникает при кавитационных режимах обтекания металла агрессивной средой, когда непрерывное возникновение и «захлопывание» мелких вакуумных пузырьков создаёт поток разрушающих микрогидравлических ударов, воздействующих на поверхность металла. Близкой разновидностью можно считать и фреттинг-коррозию, наблюдаемую в местах контакта плотно сжатых или катящихся одна по другой деталей, если в результате вибраций между их поверхностями возникают микроскопические смещения сдвига. Утечка электрического тока через границу металла с агрессивной средой вызывает в зависимости от характера и направления утечки дополнительные анодные и катодные реакции, могущие прямо или косвенно вести к ускоренному местному или общему разрушению металла (коррозия блуждающим током). Сходные разрушения, локализуемые вблизи контакта, может вызвать соприкосновение в электролите двух разнородных металлов, образующих замкнутый гальванический элемент, – контактная коррозия. В узких зазорах между деталями, а также под отставшим покрытием или наростом, куда проникает электролит, но затруднён доступ кислорода, необходимого для пассивации металла, может развиваться щелевая коррозия, при которой растворение металла в основном происходит в щели, а катодные реакции частично или полностью протекают рядом с ней на открытой поверхности. Принято выделять также биологическую коррозию, идущую под влиянием продуктов жизнедеятельности бактерий и др. организмов, и радиационную коррозию – при воздействии радиоактивного излучения.
Физико-химические свойства
Вам будет интересно: Такие обычные люди, или значение «почему бы и нет»
Наибольшее значение среди внутренних факторов коррозии имеют следующие:
- Термодинамическая устойчивость. Для ее определения в водных растворах применяют справочные диаграммы Пурбе, по оси абсцисс которых откладывается pH среды, а по оси ординат – окислительно-восстановительный потенциал. Сдвиг потенциала в положительную сторону означает большую устойчивость материала. Ориентировочно она определяется как нормальный равновесный потенциал металла. В реальности материалы корродируют с различной скоростью.
- Положение атома в периодической таблице химических элементов. Металлы, наиболее подверженные коррозии, – это щелочные и щелочноземельные. Скорость коррозии снижается при увеличении атомного номера.
- Кристаллическая структура. Она оказывает неоднозначное влияние на разрушение. Крупнозернистая структура сама по себе не приводит к росту коррозии, но благоприятна для развития межкристаллитного избирательного разрушения границ зерна. Металлы и сплавы с однородным распределением фаз корродируют равномерно, а с неоднородным – по очаговому механизму. Взаимное расположение фаз выполняет функцию анода и катода в агрессивной среде.
- Энергетическая неоднородность атомов в кристаллической решетке. Атомы с наибольшей энергией расположены в углах граней микронеровностей и являются активными центрами растворения при химической коррозии. Поэтому тщательная механическая обработка металлических деталей (шлифовка, полировка, доводка) повышает коррозионностойкость. Данный эффект объясняется также формированием более плотных и сплошных оксидных пленок на гладких поверхностях.
Влияние кислотности среды
Вам будет интересно: Шуточные номинации для учителей на выпускной
В процессе химической коррозии концентрация ионов водорода оказывает влияние на следующие моменты:
- растворимость продуктов коррозии;
- формирование защитных оксидных пленок;
- скорость разрушения металла.
При рН в интервале значений 4-10 единиц (кислый раствор) коррозия железа зависит от интенсивности проникновения кислорода к поверхности объекта. В щелочных растворах скорость коррозии сначала уменьшается из-за пассивации поверхности, а затем, при рН>13 увеличивается в результате растворения защитной оксидной пленки.
Для каждого вида металла существует своя зависимость интенсивности разрушения от кислотности раствора. Благородные металлы (Pt, Ag, Au) устойчивы к коррозии в кислой среде. Zn, Al быстро разрушаются как в кислотах, так и в щелочах. Ni и Cd устойчивы к щелочам, но легко корродируют в кислотах.
Привет студент
ПОНЯТИЕ О КОРРОЗИИ МЕТАЛЛОВ
Коррозией называется разрушение металла под химическим действием окружающей среды.
Металлы встречаются в природе преимущественно в виде соединений с неметаллическими элементами, например, железо — в виде Fe2О3 и др., алюминий — А12О3, медь — Cu2S и т. д.
Для получения металла в чистом виде необходима затрата энергии, так как металлургическими процессами нарушается равновесное состояние между металлом и веществами, с которыми он связан в естественном состоянии.
Полученные в результате металлургических процессов металлы под действием атмосферных условий (газов и влаги) снова стремятся перейти в устойчивые соединения с другими веществами, иначе говоря, корродируют.
В настоящее время коррозия выводит из строя ежегодно около 1 % находящегося в пользовании металла.
В изделиях и сооружениях в результате коррозии может происходить последовательное разрушение поверхности, образование раковин и приобретение металлом губчатого строения. Разработка современной теории коррозии основана на исследованиях Г. В. Акимова, Н. А. Изгарышева, Н. Д. Томашева и др.
ВИДЫ КОРРОЗИИ
Различают два основных вида коррозии металла: химическую и электрохимическую.
Химической коррозией называются процессы разрушения металла в сухих газах или в жидкостях, не проводящих электрического тока (масло, бензин).
Такого рода коррозия имеет, например, место при окислении металла в термических печах, при разъедании топочных связей и пр. Степень химической коррозии сильно возрастает с повышением температуры; в виде примера можно указать на цвета побежалости.
Скорость разрушения металла при химической коррозии определяется степенью сродства металла с кислородом и свойствами образующейся при этом пленки (ее плотностью, отсутствием в ней пор, прочностью прикрепления пленки к металлу).
На фиг. 158 приведен график окисления железа в зависимости от температуры.
Опыт показывает, что пленка окисла обнаруживает защитные свойства, если объем окисла больше объема окисленного металла; так, для Са, Сu и Fe отношение объема окисла к объему окисленного металла соответственно равно 0,78; 1,70 и 2,06. Защитные свойства пленки окислов меди и железа можно видеть на фиг. 159; из графика видно, что для Са пленка не обнаруживает защитных свойств.
Переменный нагрев и охлаждение металла увеличивают скорость коррозии, так как колебания температуры нарушают цельность пленки.
Химическая коррозия может разрушать металл не только с поверхности, но и между кристаллическими зернами, проникая в глубь металла. В последнем случае коррозия называется межкристаллитной.
Электрохимической коррозией называется разрушение металла при соприкосновении с жидкостями, проводящими электрический ток. Происходящие здесь явления аналогичны тем, которые имеют место в гальваническом элементе.
Металлическая пластинка, погруженная в жидкость, проводящую ток, выделяет частицы, заряженные положительно, — ионы, а сама заряжается отрицательно — электронами. Между пластинкой и жидкостью устанавливается электростатическое равновесие.
Количество ионов, выделяемое различными металлами, различно, следовательно, различны и их потенциалы.
При соединении погруженных в жидкость пластинок из разнородных металлов проводником, находящимся вне жидкости, по последнему потечет ток (фиг. 160) электронов от А к В; одновременно и в жидкости возникает ток ионов от А к В. На поверхности пластинки В ионы нейтрализуются электронами, притекшими по проводнику.
Включенный в цепь гальванометр покажет течение электричества в цепи.
В результате происходит разрушение пластинки А (анода).
В гальванической паре разрушается тот металл, который выделяет большее количество положительно заряженных ионов и, следовательно, сам получает более высокий отрицательный заряд. Для сравнения электроположительных свойств металлов их электродные потенциалы измеряются в одинаковых условиях по отношению к потенциалу водородного электрода, принятому равным нулю.
По мере убывания положительного заряда в паре с водородным электродом пли, как принято говорить, по мере убывания электроположительных свойств, металлы располагаются в ряд, называемый рядом напряжений: Au, Pt, Hg, Ag, Сu, Bi, Sb, (H2), Pb, Sn, Ni, Co, Cd, Fe, Cr, Zn, Mn, Al, Mg, Be, Na, K. Li.
Этот ряд составлен при условии, что определение электродных потенциалов производилось при нормальной концентрации раствора (в растворе, содержащем 1 г-эквивалент ионов данного металла на 1 л при 18° С).
Всякий металл, занимающий в этом ряду более правое положение, будет разрушаться в контакте с занимающими более левое положение и тем сильнее, чем дальше эти металлы находятся друг от друга в ряду.
В зависимости от электролита порядок расположения указанных металлов в ряде напряжений может быть и другой, а следовательно, может измениться и относительная способность к корродированию.
Скорость разъедания характеризуется силой тока между ними.
Величина этого тока может уменьшаться и коррозия замедляется, вследствие поляризации электродов и, в первую очередь, катода, на котором в процессе коррозии накапливаются электроны. Деполяризация катода (удаление электронов) может происходить двумя путями: а) путем выделения водорода на катоде с поглощением при этом электронов; такой процесс деполяризации имеет место в кислой среде; б) путем снятия с катода электронов газообразным кислородом, находящимся в растворе с образованием при этом гидроксил-ионов по уравнению
такого вида деполяризация характерна для нейтральных растворов.
Поляризация уменьшает электродвижущую силу пары и способна даже изменить знак потенциала. Поэтому интенсивность процесса разрушения металла при электрохимической коррозии зависит также и от степени поляризации электродов: чем больше поляризация, тем слабее коррозия и наоборот.
Различают следующие виды электрохимической коррозии: гальванокоррозйю и коррозию под влиянием блуждающих токов.
Гальваиокоррозией называется процесс разрушения металла при соприкосновении разнородных металлов в присутствии электролита; в качестве примера можно указать на разрушение железа паровых котлов, образующих гальваническую пару с топочной медью. Во многих случаях процесс гальванокоррозии обусловливается неоднородностью структуры металла или сплава. В качестве примера можно указать на разрушение перлита; здесь отрицательно заряженным является феррит (по отношению к цементиту), подвергающийся разрушению в присутствии влаги. Коррозию, возникающую в результате неоднородности структуры, т. е. вследствие наличия микроэлементов, называют микрокоррозией или структурной коррозией.
Распространенное мнение, что микрокоррозии подвергаются только сплавы, нельзя считать вполне правильным, так как неоднородность структуры может иметь место и в чистом металле, например, вследствие наклепа. Кроме того, некоторая возможность микрокоррозии чистого металла может вызываться неодинаковостью потенциалов в различных точках поверхности металла, которая никогда не бывает абсолютно однородной.
Однако очевидно, что чистые металлы могут подвергаться микрокоррозии в меньшей мере по сравнению со сложным по структуре сплавом и что микрокоррозия проявляется тем меньше, чем меньше неоднородность поверхности металла.
Вызывающие микрокоррозию токи весьма малы: величина их может быть равна приблизительно 10-6—10-7 а/см2. Малая величина этих токов компенсируется продолжительностью их действия.
В районах, обслуживаемых электрическими железными дорогами, токи, возвращающиеся из сети на станцию через рельсы, могут частично ответвляться, проходя по металлу предметов, находящихся в почве (водопроводных труб, каркасов железобетонных сооружений и пр.). В этом случае почва, содержащая растворы солей, играет роль электролита; разрушению подвергается металл, являющийся анодом. Такой вид коррозии называют коррозией под влиянием блуждающих токов.
Факторы, влияющие на скорость коррозии
Внутренние факторы. К внутренним факторам, влияющим на скорость коррозии, относятся химический состав, структура, внутренние напряжения и состояние поверхности металла. Чистые металлы при прочих равных условиях менее подвержены коррозии, чем сплавы.
Менее других подвержены коррозии сплавы, имеющие структуру твердого раствора.
Внутренние напряжения материала способствуют коррозии его; наклепанный материал разъедается больше, чем материал с нормальной структурой. Наличие внутренних напряжений и наклеп способствуют образованию гальванопар.
Чем ровнее поверхность металла, тем меньше он корродирует; при повреждении поверхности металл начинает корродировать быстрее. Причиной этого является то обстоятельство, что гладкая поверхность лучше покрывается защитной пленкой.
Внешние факторы. К внешним факторам, влияющим на скорость коррозии, относятся действие на металл окружающей среды: воды, кислот, щелочей, солей и газов, а также температура окружающей среды.
Коррозионная усталость металла
Коррозионной усталостью металла называется разрушение металла, находящегося под одновременным воздействием циклических напряжений и факторов, вызывающих коррозию.
Причиной быстрого разрушения металла является, с одной стороны, разрушение пленки окисла и, следовательно, неиспользование ее защитных свойств, а с другой — поверхностное разрушение металла, вызываемое коррозией, способствующее возникновению трещин усталости. Под влиянием коррозии предел усталости металла снижается в некоторых случаях на 65% против нормальной величины.
Скачать реферат: У вас нет доступа к скачиванию файлов с нашего сервера. КАК ТУТ СКАЧИВАТЬ
Пароль на архив: privetstudent.com
Состав и концентрация нейтральных растворов
Скорость коррозии в нейтральных растворах зависит в большей степени от свойств соли и ее концентрации:
- При гидролизе солей в коррозионной среде образуются ионы, которые действуют как активаторы или замедлители (ингибиторы) разрушения металла.
- Те соединения, которые увеличивают pH, повышают также скорость деструктивного процесса (например, кальцинированная сода), а те, которые снижают кислотность, – уменьшают ее (хлористый аммоний).
- При наличии хлоридов и сульфатов в растворе разрушение активизируется до достижения некоторой концентрации солей (что объясняется усилением анодного процесса под влиянием ионов хлора и серы), а затем постепенно снижается из-за уменьшения растворимости кислорода.
Некоторые виды солей способны образовывать труднорастворимую пленку (например, фосфорнокислое железо). Это способствует защите металла от дальнейшего разрушения. Данное свойство используется при применении нейтрализаторов ржавчины.
Замедлители коррозии
Замедлители (или ингибиторы) коррозии различаются по механизму действия на окислительно-восстановительный процесс:
- Анодные. Благодаря им образуется пассивная пленка. К данной группе относятся соединения на основе хроматов и бихроматов, нитратов и нитритов. Последний тип ингибиторов применяется для межоперационной защиты деталей. При использовании анодных замедлителей коррозии необходимо предварительно определить их минимальную защитную концентрацию, так как добавление в небольших количествах может привести к увеличению скорости разрушения.
- Катодные. Механизм их действия основан на снижении концентрации кислорода и соответственно, замедлении катодного процесса.
- Экранирующие. Данные ингибиторы изолируют поверхность металла с помощью образования нерастворимых соединений, отлагающихся в виде защитного слоя.
К последней группе относятся нейтрализаторы ржавчины, которые используются также для очистки от окислов. В их состав, как правило, входит ортофосфорная кислота. Под ее влиянием происходит фосфатирование металла – образование прочного защитного слоя нерастворимых фосфатов. Нейтрализаторы наносят пульверизатором или валиком. Через 25-30 минут поверхность приобретает бело-серый цвет. После высыхания состава наносят лакокрасочные материалы.
Способы снижения коррозии: механизм и эффективность
Способность окрашенной поверхности противостоять коррозионным процессам зависит от того, какой механизм коррозии преобладает. Например, при постоянном во времени воздействии химически активной среды существенно изменяется разность потенциалов внешней поверхности металлического изделия и его внутренних объемов. При этом возникают коррозионные токи, усиливающие процесс коррозии (явление, часто вызывающее разрушение стальных труб в подземных трубопроводах). Здесь окрашивание не дает никакого эффекта, поскольку химический состав поверхности, покрытой слоем краски, со временем не меняется.
Покрытие металлами
Иное дело, когда поверхность покрыта металлом, имеющим отрицательный электролитический потенциал по отношению к окислительно-восстановительным процессам. При преобладании окислительных реакций сталь эффективнее защитить путем нанесения поверхностного покрытия, содержащего в себе алюминий и цинк, – металлы, которые по своей кислородной активности стоят «левее» железа.
Такие процессы – цинкование и алюминирование – широко применяются в практике антикоррозионной защиты стальных узлов и отдельных деталей, находящихся в окислительной среде. Окрашивание в данных ситуациях носит вспомогательный характер, для повышения декоративных характеристик поверхности.
В восстановительной среде процесс образования гидридов железа может быть эффективно блокирован созданием поверхностных покрытий из металлов, находящихся «правее» водорода: это медь и все благородные металлы. Меднение, хоть и используется на практике, обычно выполняется для относительно небольших по площади поверхностей, поскольку является весьма затратным процессом в плане финансов. Именно для таких ситуаций можно и нужно применять окрашивание.
Окрашивание
Защитная роль красок состоит в том, что в их составе всегда присутствуют ингибиторы коррозии – компоненты, замедляющие во времени скорость протекания процессов окалинообразования. Химические формулы веществ-ингибиторов разработаны таким образом, что в результате приостанавливается появление ржавчины. Эластичность современных окрашивающих составов позволяет покрытиям успешно противостоять также и поверхностным напряжениям, которые провоцируют начало коррозионных процессов.
Антикоррозионные свойства красок увеличиваются, если в их составе находятся кремнийорганические полимеры, которые повышают способность окрашенной поверхности противостоять перепадам влажности и температуры независимо от времени года. Однако такие краски обладают двумя существенными недостатками:
- ядовиты;
- малоэффективны в условиях электролитического механизма коррозии.
Таким образом, правильно подобранные красящие составы могут достаточно эффективно блокировать коррозионные процессы. Для этого они должны содержать в себе ингибиторы коррозии, иметь достаточную эластичность и механическую прочность, незначительно изменяющуюся со временем.
Механическое воздействие
Повышению коррозии в агрессивной среде способствуют такие типы механического воздействия, как:
- Внутренние (при формовании или термообработке) и внешние (под воздействием приложенной извне нагрузки) напряжения. В результате возникает электрохимическая неоднородность, происходит снижение термодинамической устойчивости материала и формируется коррозионное растрескивание. Особенно быстро происходит разрушение при растягивающих нагрузках (трещины образуются в перпендикулярных плоскостях) в присутствии анионов окислителей, например, NaCl. Типичным примером устройств, подверженных такому типу разрушения, являются детали паровых котлов.
- Знакопеременное динамическое воздействие, вибрации (коррозионная усталость). Происходит интенсивное снижение предела усталости, образуются множественные микротрещины, которые затем сливаются в одну крупную. Число циклов до разрушения в большей степени зависит от химического и фазового состава металлов и сплавов. Такой коррозии подвержены оси насосов, рессоры, лопатки турбин и другие элементы оборудования.
- Трение деталей. Быстрое корродирование обусловлено механическим износом защитных пленок на поверхности детали и химическим взаимодействием со средой. В жидкости скорость разрушения ниже, чем на воздухе.
- Кавитационное ударное воздействие. Кавитация возникает при нарушении сплошности потока жидкости в результате образования вакуумных пузырей, которые схлопываются и создают пульсирующее воздействие. В результате возникают глубокие повреждения локального характера. Данный тип коррозии часто наблюдается в химических аппаратах.
Практика коррозионных испытаний металлов
Индикаторами коррозии являются климатические факторы – температура, состав и относительная влажность окружающей среды, характер распределения внешних нагрузок. Во внимание необходимо принимать также изменение освещенности по времени суток, количество осадков, возможное загрязнение воздуха. Например, в зонах выбросов дымовых отходов вблизи химических комбинатов и металлургических производств, сопровождающихся резким увеличением процентного содержания SO2, коррозионные процессы резко активизируются.
В качестве индикаторов коррозионной активности можно использовать количественные зависимости коррозии от времени:
- Линейные – чаще всего это характерно для металлических поверхностей, не имеющих защитного покрытия.
- Экспоненциально убывающие – встречаются при кислотной коррозии обычных металлов и сплавов.
- Экспоненциально возрастающие – когда на поверхности детали имеется защитное покрытие.
Интенсивность образования ржавчины при таких условиях снижают:
- малая скорость ветра;
- пониженная цикличность во времени изменения показателей относительной влажности;
- характер воздействия коррозионно-активной среды на поверхность.
При слабом ветре или его отсутствии нет условий для перемешивания потока, омывающего контактную поверхность стали. При длительных фазах пониженной и повышенной влажности в течение года пленка поверхностной ржавчины успевает сформироваться, набухнуть и отделиться от основного металла. Толщина поверхности снизится, зато коррозионные процессы вынуждены «запуститься» сначала, а для этого требуется не только время, но и подходящие условия – ветер или изменения в химическом составе воздуха, что бывает далеко не всегда.
Влага, кислота или щелочь могут попадать на поверхность стали в виде капель либо струйным путем. Первый способ характерен для зон с повышенным количеством осадков, а второй – для неблагоприятной окружающей среды, в которой функционирует деталь или металлическая конструкция.
Конструктивные факторы
Вам будет интересно: Копать или капать? Как правильно написать?
При конструировании элементов, работающих в агрессивных условиях, необходимо учитывать, что скорость коррозии возрастает в следующих случаях:
- при контакте разнородных металлов (чем больше разница электродного потенциала между ними, тем выше сила тока электрохимического процесса разрушения);
- при наличии концентраторов механических напряжений (канавки, пазы, отверстия и другие);
- при низкой чистоте обработанной поверхности, так как при этом возникают локальные короткозамкнутые гальванические пары;
- при значительной разнице температуры отдельных частей аппарата (образуются термогальванические элементы);
- при наличии застойных зон (щели, зазоры);
- при формировании остаточных напряжений, особенно в сварных соединениях (для их устранения необходимо предусмотреть термическую обработку – отжиг).
Методы оценки
Существует несколько способов оценки скорости разрушения металлов в агрессивных средах:
- Лабораторные – испытания образцов в искусственно смоделированных условиях, близких к реальным. Их преимуществом является то, что они позволяют сократить сроки исследования.
- Полевые – проводятся в естественных условиях. Занимают длительное время. Преимуществом такого метода является получение информации о свойствах металла в условиях дальнейшей эксплуатации.
- Натурные – испытания готовых металлических объектов в естественной среде.
Источник