Человечество научилось использовать газообразные вещества для поддержания искусственных процессов и реакций, в результате которых удаётся получить другие химические соединения. Кроме этого, различные газы используются для получения определённых физических явлений и свойств. Углекислый газ или СО2 обладает большим количеством качеств, которые не могут не использоваться в химической промышленности и быту.
Углекислый газ, формула, молекула, строение, состав, вещество:
Углекислый газ (диоксид углерода, двуокись углерода, углекислота, оксид углерода (IV), угольный ангидрид) – бесцветный газ, почти без запаха (в больших концентрациях с кисловатым «содовым» запахом).
Углекислый газ – бинарное химическое соединение углерода и кислорода, имеющее формулу CO2.
Химическая формула углекислого газа CO2.
Строение молекулы углекислого газа, структурная формула углекислого газа:
Углекислый газ тяжелее воздуха приблизительно в 1,5 раза. Его плотность при нормальных условиях составляет 1,98 кг/м3, по отношении к воздуху – 1,524. Поэтому скапливается в низких непроветриваемых местах.
Концентрация углекислого газа в воздухе (в атмосфере Земли) составляет в среднем 0,046 % (по массе) и 0,0314 % (по объему).
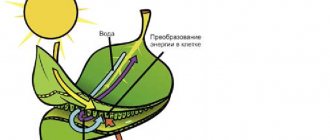
Углекислый газ вырабатывается в органах и тканях человека образуется в качестве одного из конечных продуктов метаболизма. Он переносится от тканей по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие. Таким образом, содержание углекислого газа в крови велико в венозной системе, уменьшается в капиллярной сети лёгких, и содержание его мало в артериальной крови. В выдыхаемом человеком воздухе содержится около 4,5% диоксида углерода, что в 60-110 раз больше, чем во вдыхаемом. Организм человека выделяет приблизительно 1 кг углекислого газа в сутки.
Углекислый газ растворяется в воде. В 100 граммах воды растворяется 0,3803 грамма CO2 при 16 °C, 0,3369 грамма CO2 – при 20 °C, 0,2515 грамма CO2 – при 30 °C. Растворяясь в воде, образует угольную кислоту Н2CO3. Растворим также в ацетоне, бензоле, метаноле и этаноле.
Термически устойчив при температурах менее 1000 °C. При температуре 1000 °C восстанавливается углем до оксида углерода (II).
При нормальном атмосферном давлении диоксид углерода не существует в жидком состоянии, существует только в твердом или газообразном состоянии. Твердая двуокись углерода при повышении температуры не плавится, а переходит (возгоняется) непосредственно из твёрдого состояния в газообразное. Твёрдую двуокись углерода также называют сухим льдом. Внешний вид сухого льда напоминает обычный лед, снегоподобную массу. При сублимации сухой лед поглощает около 590 кДж/кг (140 ккал/кг) теплоты.
Под давлением 35 000 атм. твердая углекислота становится проводником электрического тока.
Жидкий углекислый газ можно получить при повышении давления. Так, при температуре 20 °С и давлении свыше 6 МПа (~60 атм.) газ сгущается в бесцветную жидкость. При нормальных условиях (20 °С и 101,3 кПа) при испарении 1 кг жидкой углекислоты образуется 509 л углекислого газа. Хранят и транспортируют углекислый газ, как правило, в жидком состоянии
Двуокись углерода негорюча, но в ее атмосфере может поддерживаться горение активных металлов, например, щелочных металлов и щелочноземельных – магния, кальция, бария.
Двуокись углерода нетоксична, невзрывоопасна.
Предельно допустимая концентрация двуокиси углерода в воздухе рабочей зоны не установлена, при оценке этой концентрации можно ориентироваться на нормативы для угольных и озокеритовых шахт, установленные в пределах 0,5% (об.) или 9,2 г/м (см. ГОСТ 8050-85 «Двуокись углерода газообразная и жидкая. Технические условия»).
По степени воздействия на организм человека двуокись углерода относится к 4-му классу опасности по ГОСТ 12.1.007-76.
При концентрациях более 5% (92 г/м) двуокись углерода оказывает вредное влияние на здоровье человека, так как она тяжелее воздуха в полтора раза и может накапливаться в слабопроветриваемых помещениях у пола и в приямках, а также во внутренних объемах оборудования для получения, хранения и транспортирования газообразной, жидкой и твердой двуокиси углерода. При этом снижается объемная доля кислорода в воздухе, что может вызвать явление кислородной недостаточности и удушья.
Углекислый газ образуется при гниении и горении органических веществ, в результате вулканической деятельности. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Искусственными источниками образования углекислого газа являются промышленные выбросы и выхлопные газы автомобильного транспорта.
Углекислый газ легко пропускает излучение в ультрафиолетовой и видимой частях спектра, которое поступает на Землю от Солнца и обогревает её. В то же время он поглощает испускаемое Землёй инфракрасное излучение и является одним из парниковых газов, вследствие чего участвует в процессе глобального потепления.
Применение
В пищевой промышленности диоксид углерода используется как консервант и обозначается на упаковке под кодом Е290
, а также в качестве разрыхлителя теста.
Жидкая углекислота (жидкая пищевая углекислота) — сжиженный углекислый газ, хранящийся под высоким давлением (
65-70 Атм). Бесцветная жидкость. При выпуске жидкой углекислоты из баллона в атмосферу часть её испаряется, а другая часть образует хлопья сухого льда.
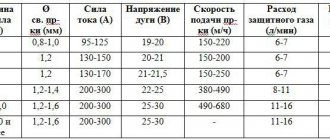
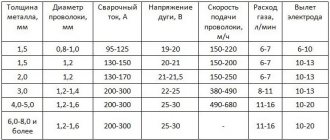
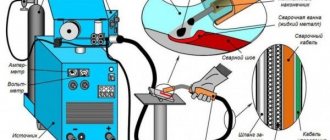
Баллоны с жидкой углекислотой широко применяются в качестве огнетушителей и для производства газированной воды и лимонада. Углекислый газ используется в качестве активной среды при сварке проволокой так как при температуре дуги углекислота разлагается на угарный газ СО и кислород который в свою очередь и входит в заимодействие с жидким металом окисляя его. Углекислота в баллончиках применяется в пневматическом оружии и в качестве источника энергии для двигателей в авиамоделировании.
Читать также: Заземление в сельском доме
Твёрдая углекислота — сухой лёд — используется в качестве хладагента в ледниках и морозильных установках.
Получение углекислого газа:
В промышленности углекислый газ образуется в дымовых газах при сжигании различных органических и неорганических веществ или как побочный продукт химических процессов, например, при разложении природных карбонатов (доломита, известняка). Также углекислый газ как побочный продукт получают на установках разделения воздуха с целью получения чистого кислорода, азота и аргона.
В лабораторных условиях углекислый газ получают, например, в результате следующих химических реакций:
1. взаимодействия карбоната кальция и азотной кислоты:
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O,
2. в результате взаимодействия карбоната кальция с другими минеральными кислотами,
3. взаимодействия пищевой соды с лимонной кислотой или с кислым лимонным соком,
4. реакции горения углерода:
С + O2 → CO2.
[править] Применение
В народном хозяйстве диоксид углерода широко применяется в химической промышленности при производстве соды, мочевины и т. п., а также в производстве сахара, вина, пива, для изготовления газированной воды и т. д. Широко известны природные источники диоксида углерода в виде минеральных вод «Нарзан», «Боржоми» и другие. Спрессованный твердый CO2 под названием «сухой лед» применяют для охлаждения мяса, рыбы и других пищевых продуктов, которые быстро портятся. Сухой лед гораздо больше, чем обычный, снижает температуру и при испарении не оставляет никакой жидкости. В промышленности диоксид углерода получают разложением карбоната кальция:
Химические свойства углекислого газа. Химические реакции (уравнения) углекислого газа:
Диоксид углерода относится к кислотным оксидам, поэтому для него характерны следующие химические реакции:
1. реакция взаимодействия оксида углерода (IV) и водорода:
CO2 + 4H2 → CH4 + 2H2O (t ~ 200 °C, kat = Cu2O).
В результате реакции образуются метан и вода.
2. реакция взаимодействия оксида углерода (IV) и углерода:
CO2 + C ⇄ 2CO (t = 700-1000 °C).
В результате реакции образуется оксид углерода (II). Реакция протекает при взаимодействии углекислого газа с раскаленными углями.
3. реакция взаимодействия оксида углерода (IV) и магния:
CO2 + 2Mg → 2MgO + C (t ~ 500 °C).
В результате реакции образуются оксид магния и углерод.
4. реакция взаимодействия оксида углерода (IV) и гафния:
Hf + CO2 → HfC + HfO2 (t = 800-1000 °C).
В результате реакции образуются карбид гафния и оксид гафния.
5. реакция взаимодействия оксида углерода (IV) и германия:
Ge + CO2 → GeO + CO (t = 700-900 °C).
В результате реакции образуются оксид германия и оксид углерода (II).
6. реакция взаимодействия оксида углерода (IV) и цинка:
Zn + CO2 → ZnO + CO (t = 800-950 °C).
В результате реакции образуются оксид цинка и оксид углерода (II).
7. реакция взаимодействия оксида углерода (IV) и индия:
2In + CO2 → In2O + CO (t ~ 850 °C).
В результате реакции образуются оксид индия и оксид углерода (II).
8. реакция взаимодействия оксида углерода (IV) и циркония:
2Zr + CO2 → ZrC + ZrO2 (t = 800-100 °C).
В результате реакции образуются карбид циркония и оксид циркония.
9. реакция взаимодействия оксида углерода (IV) и вольфрама:
W + 2CO2 → WO2 + 2CO (t ~ 1200 °C).
В результате реакции образуются оксид вольфрама и оксид углерода (II).
10. реакция взаимодействия оксида углерода (IV) и оксида лития:
Li2O + CO2 → Li2CO3.
В результате реакции образуется карбонат лития.
11. реакция взаимодействия оксида углерода (IV) и оксида натрия:
Na2O + CO2 → Na2CO3 (t = 450-550 °C).
В результате реакции образуется карбонат натрия.
12. реакция взаимодействия оксида углерода (IV) и оксида калия:
K2O + CO2 → K2CO3 (t ~ 400 °C).
В результате реакции образуется карбонат калия.
13. реакция взаимодействия оксида углерода (IV) и оксида бария:
BaO + CO2 → BaCO3.
В результате реакции образуется карбонат бария.
14. реакция взаимодействия оксида углерода (IV) и оксида кальция:
CaO + CO2 → CaCO3.
В результате реакции образуется карбонат кальция.
15. реакция взаимодействия карбоната кальция, оксида углерода (IV) и воды:
CaCO3 + CO2 + H2O → Ca(HCO3)2.
В результате реакции образуется гидрокарбонат кальция.
16. реакция взаимодействия оксида углерода (IV) и оксида магния:
MgO + CO2 → MgCO3.
В результате реакции образуется карбонат магния.
17. реакция взаимодействия оксида углерода (IV) и оксида кремния (II):
SiO + CO2 → SiO2 + CO (t ~ 500 °C).
В результате реакции образуются оксид кремния (IV) и оксид углерода (II).
18. реакция взаимодействия оксида углерода (IV) и воды:
CO2 + H2O ⇄ H2CO3.
В результате реакции образуется угольная кислота.
19. реакция взаимодействия оксида углерода (IV) и гидроксида лития:
2LiOH + CO2 → Li2CO3 + H2O.
В результате реакции образуются карбонат лития и вода. В ходе реакции используется концентрированный раствор гидроксида лития.
20. реакция взаимодействия оксида углерода (IV) и гидроксида калия:
KOH + CO2 → KHCO3,
2KOH + CO2 → K2CO3 + H2O.
В первом случае в результате реакции образуются гидрокарбонат калия, во втором случае – карбонат калия и вода. Реакция протекает в первом случае в этаноле и используется разбавленный раствор гидроксида калия, во втором используется концентрированный раствор гидроксида калия.
21. реакция взаимодействия оксида углерода (IV) и гидроксида натрия:
NaOH + CO2 → NaHCO3,
2NaOH + CO2 → Na2CO3 + H2O.
В первом случае в результате реакции образуются гидрокарбонат натрия, во втором – карбонат натрия и вода. В ходе первой реакции используется разбавленный раствор гидроксида натрия, в ходе второй – концентрированный раствор гидроксида натрия.
22. реакция взаимодействия оксида углерода (IV) и гидроксида кальция:
Ca(OH)2 + CO2 → CaCO3 + H2O.
В результате реакции образуются карбонат кальция и вода.
23. реакция взаимодействия оксида углерода (IV) и гидроксида бария:
Ba(OH)2 + CO2 → BaCO3 + H2O.
В результате реакции образуются карбонат бария и вода.
24. реакция взаимодействия оксида углерода (IV) и метана:
CH4 + CO2 → 2CO + 2H2 (t = 800-900 °C, kat = NiO, нанесенный на Al2O3).
В результате реакции образуются оксид углерода (II) и вода.
25. реакция термического разложения оксида углерода (IV):
2CO2 → 2CO + O2 (t > 2000 °C).
В результате реакции образуются оксид углерода (II) и кислород.
26. реакция фотосинтеза:
6CO2 + 6H2O → C6H12O6 + 6O2 (hv, kat = хлорофилл).
В результате реакции образуются глюкоза и кислород.
Области применения диоксида углерода
В повседневной практике двуокись углерода используют достаточно часто. В пищевой индустрии углекислый газ используют в качестве разрыхлителя теста, а также в качестве консерванта. Его обозначают на упаковке продукта под кодом Е290. Свойства диоксида углерода также используют при производстве газированной воды.
Биохимики выяснили, что для повышения урожайности различных культур весьма эффективно удобрять воздух углекислым газом. Однако данный способ удобрения можно применять только в оранжереях. В сельском хозяйстве газ применяют для создания искусственного дождя. При нейтрализации щелочной среды двуокись углерода заменяет сильнодействующие минеральные кислоты. В овощехранилищах углекислый газ применяют для создания газовой среды.
В парфюмерной промышленности двуокись углерода применяют при изготовлении духов. В медицине углекислый газ используют для антисептического воздействия при проведении открытых операций.
При охлаждении углекислый газ превращается в «сухой лед». Сжиженный диоксид углерода расфасовывают в баллоны и отправляют потребителям. Углекислый газ в виде «сухого льда» используют для сохранения пищевых продуктов. Такой лед при нагревании испаряется без остатка.
Углекислый газ используют как активную среду при сварке проволокой. При сварке двуокись углерода разлагается на кислород и угарный газ. Кислород вступает во взаимодействие с жидким металлом и окисляет его.
В авиамоделировании двуокись углерода используется как источник энергии для двигателей. Двуокись углерода в баллончиках используется в пневматическом оружии.