| Кислород | |
| Атомный номер | 8 |
| Внешний вид простого вещества | газ без цвета, вкуса и запаха голубоватая жидкость (при низких температурах) |
| Свойства атома | |
| Атомная масса (молярная масса) | 15,9994 а. е. м. (/моль) |
| Радиус атома | 60 (48) |
| Энергия ионизации (первый электрон) | 1313,1 (13,61) кДж/моль () |
| Электронная конфигурация | [He] 2s2 2p4 |
| Химические свойства | |
| Ковалентный радиус | 73 |
| Радиус иона | 132 (-2e) |
| Электроотрицательность (по Полингу) | 3,44 |
| Электродный потенциал | 0 |
| Степени окисления | -2, −1, 0 ,+1, +2, -½ |
| Термодинамические свойства простого вещества | |
| Плотность | 0,00142897 /³ |
| Молярная теплоёмкость | 29,4 /(·моль) |
| Теплопроводность | 0,027 /(·) |
| Температура плавления | 54,8 |
| Теплота плавления | 0,444 кДж/моль |
| Температура кипения | 90,19 |
| Теплота испарения | 3,4099 кДж/моль кДж/моль |
| Молярный объём | 14,0 ³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | моноклинная |
| Параметры решётки | a=5,403 b=3,429 c=5,086 β=135,53 |
| Отношение c/a | — |
| Температура Дебая | 155 |
| O | 8 |
| 15,9994 | |
| [He]2s22p4 | |
| Кислород | |
Кислород
— элемент главной подгруппы шестой группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 8. Обозначается символом
O
(Oxygenium). Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов. Простое вещество
кислород
(CAS-номер: 7782-44-7) при нормальных условиях — газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2), в связи с чем его также называют
дикислород
. Жидкий кислород имеет светло-голубой цвет.
Существуют и другие аллотропные формы кислорода, например, озон
(CAS-номер: 10028-15-6) — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода (формула O3).
История открытия
Схема атома кислорода
Официально считается, что кислород был открыт английским химиком Джозефом Пристли первого августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).
2HgO (t) → 2Hg + O2↑
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье. В 1775 году А. Лавуазье установил, что кислород является составной частью воздуха, кислот и содержится во многих веществах.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Петра Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория. Лавуазье провел опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожженных элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Пероксид водорода.
Другим соединением, состоящим только из водорода и кислорода, является пероксид водорода H2O2. Название «пероксид» принято для соединений, содержащих связь –O–O–. Пероксид водорода имеет строение асимметрично изогнутой цепи:
Пероксид водорода получают по реакции пероксида металла с кислотой
BaO2 + H2SO4® BaSO4 + H2O2
либо разложением пероксодисерной кислоты H2S2O8, которую получают электролитически:
Концентрированный раствор H2O2 может быть получен специальными методами дистилляции. Пероксид водорода используют как окислитель в двигателях ракет. Разбавленные растворы пероксида служат антисептиками, отбеливателями и мягкими окислителями. H2O2 добавляют ко многим кислотам и оксидам для получения соединений, аналогичных гидратам. В присутствии сильного окислителя (например, MnO2 или MnO4–) H2O2 окисляется, выделяя кислород и воду.
Происхождение названия
Слово кислород
(именовался в начале XIX века ещё «кислотвором») своим появлением в русском языке до какой-то степени обязано М. В. Ломоносову, который ввёл в употребление, наряду с другими неологизмами, слово «кислота»; таким образом слово «кислород», в свою очередь, явилось калькой термина «
оксиген
» (
l’oxygène
), предложенного А. Лавуазье (греческое όξύγενναω от ὀξύς — «кислый» и γενναω — «рождаю»), который переводится как «
порождающий кислоту
», что связано с первоначальным значением его — «кислота», ранее подразумевавшим окислы, именуемые по современной международной номенклатуре оксидами.
Количество вещества
В химии для удобства расчетов используется одна из важнейших физических величин — количество вещества. Относится она не к массе, а к числу структурных единиц. За единицу измерения количества вещества в Международной системе (СИ) принят 1 моль. Зная, что 1 моль включает столько же частиц, сколько их содержится в 12 г углеродного изотопа 12С, можно рассчитать число атомов, молекул, ионов, электронов, содержащихся в навеске любого вещества. Еще одна постоянная величина получила название в честь великого итальянского ученого Авогадро (обозначается NА), Она характеризует число структурных частиц, которые содержит вещество, если его количество — 1 моль. Численное значение постоянной Авогадро — 6,02 . 1023 1/моль. Именно такое количество атомов (молекул, ионов) обладает молярной массой. Обозначение этой физической величины — М, единица измерения — 1 г/моль, формула для расчета — М = m/n (m — масса (г), n — количество вещества (моль)).
Нахождение в природе
Кислород — самый распространенный на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов), приходится около 47,4 % массы твердой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 88,8 %(по массе), в атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,12 % по массе. Более 1500 соединений земной коры в своем составе содержат кислород.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %.
Как находят молярную массу элемента или вещества?
При выполнении химических расчетов нужно знать массы участвующих в реакциях атомов и молекул веществ. Но они слишком малы, что затрудняет использование таких единиц измерения, как граммы и килограммы. Выход был найден: предложены другие величины, облегчающие расчеты. Например, в химии используются относительные значения атомных и молекулярных масс. Относительная масса атома (Ar) как физическая величина была введена в 1961 году. Ее значение равно 1/12 массы атома углерода (изотопа 12C).
Для выполнения расчетов по формулам и уравнениям с применением этой и других величин нужно помнить несколько правил:
- Масса атома указана в периодической системе рядом с химическим знаком. Молярная масса имеет такое же численное значение, но с единицами измерения г/моль.
- Массу одного моля вещества определяют по формуле соединения, для чего находят сумму молярных масс всех частиц в молекуле.
- Если в химической формуле есть индекс, указывающий на количество структурных единиц, то необходимо умножить молярную массу на этот коэффициент.
Получение
В настоящее время в промышленности кислород получают из воздуха. В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа. Важнейшим лабораторным способом его получения служит электролиз водных растворов щелочей. Небольшие количества кислорода можно также получать взаимодействием раствора перманганата калия с подкисленным раствором пероксида водорода. Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной и азотной технологий. При нагревании перманганат калия KMnO4 разлагается до манганата калия K2MnO4 и диоксида марганца MnO2 с одновременным выделением газообразного кислорода O2:
2KMnO4 → K2MnO4 + MnO2 + O2↑
В лабораторных условиях получают также каталитическим разложением пероксида водорода Н2О2:
2Н2О2 → 2Н2О + О2↑
Катализатором является диоксид марганца (MnO2) или кусочек сырых овощей (в них содержатся ферменты, ускоряющие разложение пероксида водорода).
Кислород можно также получить каталитическим разложением хлората калия (бертолетовой соли) KClO3:
2KClO3 → 2KCl + 3O2↑
Катализатором также выступает MnO2.
Кислород — распространение кислорода в природе и получение
Кислород – элемент (О), кислород – простое вещество (), воздух
В виде простого вещества кислород входит в состав воздуха, что впервые установил в 1770 г. шведский химик К. Шееле. Объемное содержание кислорода в воздухе 21%. Эта величина (округлена до 20%) часто используется при решении задач. В земной коре в составе химических соединений содержится около 49% кислорода. Это видно из формул следующих природных соединений: – вода, – песок, – глина, – мрамор и т. д. Кислород входит также в состав важнейших органических соединений живых организмов: белков, липидов, углеводов и др.
В Периодической таблице Д. И. Менделеева кислород находится на 8-м месте, химический знак – O (oxygenium). Относительная атомная масса – 16. Кислород в соединениях проявляет валентность II.
Строение атома кислорода:
В воздухе содержится, кроме кислорода, азот – 78%; примерно 1% составляют инертные газы (гелий, неон, аргон и др.), что было установлено учеными в конце ХIX века. Это постоянные компоненты воздуха. Есть и переменные компоненты – загрязняющие газы, состав которых зависит от местных условий (≈ 1%). К ним относятся углекислый газ и водяные пары. Таким образом, воздух является смесью газов.
Массовая доля кислорода в воздухе – 23%. Запас кислорода в воздухе т, из них т расходуется на горение.
Количество кислорода в воздухе все время уменьшается под влиянием различных техногенных факторов, которые зависят от хозяйственной ориентации каждого конкретного региона. В то же время содержание кислорода в воздухе пополняется за счет процесса фотосинтеза, который идет непрерывно, поэтому состав воздуха остается примерно постоянным (рис. 28).
Экологическая обстановка в нашей республике, в первую очередь в промышленных городах, ухудшается из года в год (Усть-Каменогорск, Павлодар, Тараз, Шымкент, Караганда, Текели и т. д.). Усиливает этот процесс и увеличение количества автомобилей.
До некоторого предела переменные компоненты воздуха не влияют на окружающую среду. Это количество называется предельно допустимой концентрацией (ПДК). Если содержание вредных примесей превышает ПДК, появляется опасность отравления и т. п. Организм человека чувствует снижение концентрации кислорода более чем на 1%.
Ученые всего мира упорно работают над созданием новейших экологически чистых технологий, ведь воздух определяет саму возможность жизни на Земле.
Вам уже знакомы реакции окисления – процессы взаимодействия простых и сложных веществ с кислородом.
Как химический элемент кислород образует два простых вещества: – кислород и – озон.
Из курса биологии вы уже знаете, что в процессе фотосинтеза растения поглощают углекислый газ и выделяют кислород, которым мы дышим. Растения являются «легкими» планеты. Поэтому не случайно в народе говорят: «Каждый должен вырастить хотя бы одно дерево». В последние годы в Казахстане по программе «Жасыл ел» ежегодно высаживают несколько сотен тысяч саженцев. Например, Астана окружена несколькими «зелеными поясами». Их площадь достигла 78 тыс. гектаров. Эти меры способствуют улучшению состава воздуха.
Физические свойства
Кислород – бесцветный газ, без вкуса и запаха, температура кипения – 183°С, плотность 1,43 г/л, тяжелее воздуха. Мало растворим в воде: в 1 л воды при нормальных условиях растворяется 0,04 г кислорода (табл. 9).
Получение кислорода
Промышленный способ получения кислорода заключается в сжижении воздуха при низких температурах и его перегонке. Вначале из жидкого воздуха отгоняют газообразный азот (его температура кипения ниже, чем у кислорода). В жидком состоянии остается почти чистый кислород. Его хранят в баллонах голубого цвета, так как жидкий кислород имеет светло-голубой цвет (рис. 29).
Лабораторные способы получения кислорода основаны на реакциях разложения некоторых богатых кислородом веществ.
1. Разложение перманганата калия. В сухую пробирку насыпаем немного вещества и, закрыв пробирку пробкой с газоотводной трубкой, осторожно нагреваем. При этом протекает химическая реакция:
2. Каталитическое разложение пероксида водорода (рис. 30).
Тлеющей лучинкой проверяем наполненность пробирки кислородом. Если ее поднести к отверстию трубки, она вспыхнет.
3. Каталитическое разложение хлората калия.
Для ускорения этой реакции добавляем к хлорату немного оксида марганца (IV) и нагреваем. Вещества, ускоряющие реакцию и при этом не расходующиеся, называются катализаторами.
Выделившийся кислород можно собрать двумя способами:
1) вытеснением воздуха, так как кислород тяжелее (рис. 31, а): 2) вытеснением воды, т. к. он плохо растворяется в воде (рис. 31, б).
В 1774 г. английский ученый Д. Пристли получил кислород разложением оксида ртути (II):
Для хранения газов в лабораториях используют газометр (рис. 32). Газометр состоит из сосуда и большой воронки, конец которой немного не доходит до дна сосуда. Воронка, снабженная краном, вставляется в сосуд на шлифе, обеспечивающем герметичность прибора. Перед наполнением газометра газом воздух из него вытесняют водой. Для этого открывают краны 1 и 2. Через воронку 3 вливают воду и доверху заполняют ею газометр. Затем закрывают оба крана, вынимают пробку из тубуса 4 и вводят в газометр конец газоотводной трубки от прибора для получения газа. Газ поступает в газометр, вытесняя из него воду, которая выливается в стеклянную ванну или раковину. После наполнения газометра газом закрывают нижнее отверстие 4 пробкой и наливают воду в воронку 3. Для выпуска газа из газометра открывают кран 1 и слегка – кран 2. При этом вода из воронки поступает в сосуд и вытесняет из него газ, который выходит через газоотводную трубку и может быть направлен в сосуд-приемник.
В газометре можно хранить газы, малорастворимые в воде и не взаимодействующие с ней. Взрывоопасные газы нельзя хранить в газометре.
Демонстрация №4 Разложение пероксида водорода
Опыт проводит учитель, учащиеся наблюдают, делают выводы. Цель: Уметь получать кислород и собирать двумя способами.
1. Закрепите вертикально в зажиме штатива термостойкую пробирку.
2. В пробирку наберите немного раствора пероксида водорода и всыпьте в пробирку заранее приготовленного порошка диоксида марганца.
3. Опустите в пробирку тлеющую лучинку. Затем пробирку закройте пробкой с газоотводной трубкой. Опыт можно провести в термостойком стакане (рис. 33).
Физические свойства
Холодная вода содержит больше растворенного O2
При нормальных условиях кислород это газ без цвета, вкуса и запаха. 1л его весит 1,429 г. Немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100г при 0 °C, 2,09 мл/100г при 50 °C) и спирте (2,78 мл/100г при 25 °C). Хорошо растворяется в расплавленном серебре (22 объёма O2 в 1 объёме Ag при 961 °C). Является парамагнетиком.
При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы: при 2000 °C — 0,03 %, при 2600 °C — 1 %, 4000 °C — 59 %, 6000 °C — 99,5 %.
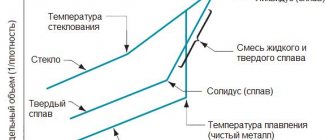
Жидкий кислород (темп. кипения −182,98 °C) это бледно-голубая жидкость.
Фазовая диаграмма O2
Твердый кислород (темп. плавления −218,79 °C) — синие кристаллы. Известны шесть кристаллических фаз, из которых три существуют при давлении в 1 атм.:
α-О2
— существует при температуре ниже 23,65 К; ярко-синие кристаллы относятся к моноклинной сингонии, параметры ячейки a=5,403 Å, b=3,429 Å, c=5,086 Å; β=132,53° .
β-О2
— существует в интервале температур от 23,65 до 43,65 К; бледно-синие кристаллы (при повышении давления цвет переходит в розовый) имеют ромбоэдрическую решётку, параметры ячейки a=4,21 Å, α=46,25°.
γ-О2
— существует при температурах от 43,65 до 54,21 К; бледно-синие кристаллы имеют кубическую симметрию, период решётки a=6,83 Å .
Ещё три фазы образуются при высоких давлениях:
δ-О2
интервал температур до 300 К и давление 6-10 ГПа, оранжевые кристаллы;
ε-О2
давление от 10 и до 96 ГПа, цвет кристаллов от темно красного до чёрного, моноклинная сингония;
ζ-О2
давление более 96 ГПа, металлическое состояние с характерным металлическим блеском, при низких температурах переходит в сверхпроводящее состояние.
Чему равна молярная масса кислорода
На практике нет необходимости пользоваться формулой М = m/n для вычисления молярной массы кислорода. При решении задач чаще требуется определить, чему равна масса, или найти количество вещества. В первом случае используют для расчетов формулу m = n . M, во втором — n = m/M. Численное значение молярной массы элемента совпадает с массой атома, а для вещества — молекулы. Например, массу 16 г имеет 1 моль элемента кислорода. М (О2) — молярная масса молекулы кислорода, которая равна 32 г/моль.
Химические свойства
Сильный окислитель, взаимодействует, практически, со всеми элементами, образуя оксиды
. Степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры. Пример реакций, протекающих при комнатной температуре: 4K + O2 → 2K2O 2Sr + O2 → 2SrO
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления: 2NO + O2 → 2NO2
Окисляет большинство органических соединений: CH3CH2OH + 3O2 → 2CO2 + 3H2O
При определенных условиях можно провести мягкое окисление органического соединения: CH3CH2OH + O2 → CH3COOH + H2O
Кислород не окисляет и , галогены и инертные газы.
Кислород образует
пероксидысо степенью окисления −1.
— Например, пероксиды получаются при сгорании щелочных металлов в кислороде: 2Na + O2 → Na2O2
— Некоторые окислы поглощают кислород: 2BaO + O2 → 2BaO2
— По принципам горения, разработанным А. Н. Бахом и К. О. Энглером, окисление происходит в две стадии с образованием промежуточного пероксидного соединения. Это промежуточное соединение можно выделить, например, при охлаждении пламени горящего водорода льдом, наряду с водой, образуется перекись водорода: H2 + O2 → H2O2
Надпероксиды
имеют степень окисления −1/2, то есть один электрон на два атома кислорода (ион O2-). Получают взаимодействием пероксидов с кислородом при повышенных давлениям и температуре: Na2O2 + O2 → 2NaO2
Озониды
содержат ион O3- со степенью окисления −1/3. Получают действием озона на гидроксиды щелочных металлов: КОН(тв.) + О3 → КО3 + КОН + O2
Ион диоксигенил
O2+ имеет степень окисления +1/2. Получают по реакции: PtF6 + O2 → O2PtF6
Фториды кислорода
Дифторид кислорода
, OF2 степень окисления +2, получают пропусканием фтора через раствор щелочи: 2F2 + 2NaOH → OF2 + 2NaF + H2O
Монофторид кислорода
(
Диоксидифторид
), O2F2, нестабилен, степень окисления +1. Получают из смеси фтора с кислородом в тлеющем разряде при температуре −196 °C.
Пропуская тлеющий разряд через смесь фтора с кислородом при определенных давлении и температуре получаются смеси высших фторидов кислорода O3F2, О4F2, О5F2 и О6F2. Кислород поддерживает процессы дыхания, горения, гниения. В свободном виде элемент существует в двух аллотропных модификациях:O2 и O3 (озон).
Молекулярный кислород.
Как большинство других элементов, у атомов которых для достройки внешней оболочки из 8 электронов не хватает 1–2 электронов, кислород образует двухатомную молекулу. В этом процессе выделяется много энергии (~490 кДж/моль) и соответственно столько же энергии необходимо затратить для обратного процесса диссоциации молекулы на атомы. Прочность связи O–O настолько высока, что при 2300° С только 1% молекул кислорода диссоциирует на атомы. (Примечательно, что при образовании молекулы азота N2 прочность связи N–N еще выше, ~710 кДж/моль.)
Применение кислорода
Широкое промышленное применение кислорода началось в середине XX века, после изобретения турбодетандеров — устройств для сжижения и разделения жидкого воздуха.
В металлургии
Конвертерный способ производства стали связан с применением кислорода.
Сварка и резка металлов
Кислород в баллонах широко используется для газопламенной резки и сварки металлов.
Ракетное топливо
В качестве окислителя для ракетного топлива применяется жидкий кислород, пероксид водорода, азотная кислота и другие богатые кислородом соединения. Смесь жидкого кислорода и жидкого озона — один из самых мощных окислителей ракетного топлива (удельный импульс смеси водород — озон превышает удельный импульс для пары водород-фтор и водород-фторид кислорода).
В медицине
Кислород используется для обогащения дыхательных газовых смесей при нарушении дыхания, для лечения астмы, в виде кислородных коктейлей, кислородных подушек и т. д.
В пищевой промышленности
В пищевой промышленности кислород зарегистрирован в качестве пищевой добавки E948
, как пропеллент и упаковочный газ.
Характеристики кислорода
Характеристики O2 представлены в таблицах ниже:
Коэффициент перевода объема и массы O2 при Т=15°С и Р=0,1 МПа
| Масса, кг | Объем | |
| Газ, м3 | Жидкость, л | |
| 1,337 | 1 | 1,172 |
| 1,141 | 0,853 | 1 |
| 1 | 0,748 | 0,876 |
Коэффициенты перевода объема и массы O2 при Т=0°С и Р=0,1 МПа
| Масса, кг | Объем | |
| Газ, м3 | Жидкость, л | |
| 1,429 | 1 | 1,252 |
| 1,141 | 0,799 | 1 |
| 1 | 0,700 | 0,876 |
Кислород в баллоне
| Наименование | Объем баллона, л | Масса газа в баллоне, кг | Объем газа (м3) при Т=15°С, Р=0,1 МПа |
| O2 | 40 | 8,42 | 6,3 |
Благодаря этой таблице теперь можно легко дать ответы на вопросы, которые очень часто задают сварщики:
- Сколько кислорода в баллоне в м3? Ответ: в 40 литровом баллоне 6,3 м3
- Сколько в баллоне кислорода? Ответ: в 40 литровом баллоне 6,3 м3 или 8,42 кг
- Сколько весит баллон кислорода? Ответ: 58,5 кг — масса пустого баллона из углеродистой стали согласно ГОСТ 949; 8,42 — кг масса кислорода в баллоне; Итого: 58,5 + 8,42 = 69,92 кг вес баллона с кислородом.
Для того, чтобы приблизительно узнать сколько кислорода в баллоне, нужно вместимость баллона (м3) умножить на давление (МПа). Например, если вместимость баллона 40 литров (0,04 м3), а давление газа 15 МПа, то объем кислорода в баллоне равен 0,04×15=6 м3.
Биологическая роль кислорода
Живые существа дышат кислородом воздуха. Широко используется кислород в медицине. При сердечно-сосудистых заболеваниях, для улучшения обменных процессов, в желудок вводят кислородную пену («кислородный коктейль»). Подкожное введение кислорода используют при трофических язвах, слоновости, гангрене и других серьёзных заболеваниях. Для обеззараживания и дезодорации воздуха и очистки питьевой воды применяют искусственное обогащение озоном. Радиоактивный изотоп кислорода 15O применяется для исследований скорости кровотока, лёгочной вентиляции.
Атомная и молекулярная масса кислорода
Масса атома кислорода получена с учетом количества и распространения трех его природных изотопов: Ar (О) = 15,999 (в а. е. м.). В расчетах это значение обычно округляют, получается 16. Для каждого элемента его атомная масса — постоянная величина. По известной массе атомов элемента с порядковым номером 8 может быть найдена молярная масса элемента кислорода. М(О) = 16. Еще одна безразмерная физическая величина — молекулярная масса кислорода — относится к простому веществу. Вычисляют массу молекулы кислорода, умножив массу атома на стехиометрический коэффициент в формуле: Mr(O2) = Ar (О) . 2 = 16 . 2 = 32. На практике нет необходимости выяснять, какая молярная масса кислорода, ведь ее значение численно равно массе молекулы вещества, но с единицей измерения г/моль. Для конкретного соединения его молекулярная масса является постоянной величиной, широко используется при расчетах количества и массы вещества.
Изотопы кислорода
Кислород имеет три устойчивых изотопа: 16О, 17О и 18О, среднее содержание которых составляет соответственно 99,759 %, 0,037% и 0,204% от общего числа атомов кислорода на Земле. Резкое преобладание в смеси изотопов наиболее легкого из них 16О связано с тем, что ядро атома 16О состоит из 8 протонов и 8 нейтронов. А такие ядра, как следует из теории строения атомного ядра, обладают особой устойчивостью.
Имеются радиоактивные изотопы 11О, 13О, 14О (период полураспада 74 сек), 15О (Т1/2=2,1 мин), 19О (Т1/2=29,4 сек), 20О (противоречивые данные по периоду полураспада от 10 мин до 150 лет).
Кислород
При стандартной температуре и давлении, кислород представляет собой бесцветный, безвкусный газ, не имеющий запаха, с молекулярной формулой O2, называемый диоксидом. Являясь диоксидом, кислород имеет два атома, химически связанных друг с другом. Эта связь может быть описана по-разному, на основе уровня теории, но разумно и просто описывается как ковалентная двойная связь, которая возникает в результате заполнения молекулярных орбиталей, образованных из атомных орбиталей отдельных атомов кислорода, заполнение которых приводит к связи порядка двух. Более конкретно, двойная связь является результатом последовательной, низкой и высокой энергии или Aufbau, заполняя орбитали и, как следствие, отменяя вклады двух электронов после последовательного заполнения низких σ и σ*-орбиталей; σ перекрытие двух атомных 2p-орбиталей, лежащих вдоль молекулярной оси OO и формируя π-перекрытие двух пар атомных 2p-орбиталей, перпендикулярных оси OO-молекул, а затем отменяя вклады от оставшихся двух из шести 2p-электронов после их частичного заполнения наименьших π- и π*-орбиталей [24]. Эта комбинация аннулирования σ и π перекрытий приводит к характеру и реакционной способности двойного связывания диоксида и триплетному электронному основному состоянию. Конфигурация электронов с двумя неспаренными электронами, найденная в двуосных орбиталях с равной энергией, представляют собой конфигурацию, называемую триплетным состоянием спина. Следовательно, основное состояние молекулы O2 называется триплетным кислородом. При наивысшей энергии, частично заполненные орбитали являются антисвязывающими, и поэтому их заполнение ослабляет порядок связей с трех до двух. Из-за его неспаренных электронов, триплетный кислород медленно реагирует с большинством органических молекул, которые имеют парные спины электронов; это предотвращает самовозгорание. В триплетной форме, молекулы O2 парамагнитны. То есть, они придают магнитный характер кислороду, когда он находится в присутствии магнитного поля, из-за спиновых магнитных моментов неспаренных электронов в молекуле и отрицательной энергии обмена между соседними молекулами O2. Жидкий кислород настолько магнитен, что в лабораторных демонстрациях мостик жидкого кислорода может поддерживаться против собственного веса между полюсами мощного магнита. 10) Синглетный кислород – это название, присвоенное нескольким более высокоэнергетическим видам молекулярного O2, в котором все спины электронов спарены. Он намного более реактивен с общими органическими молекулами, чем молекулярный кислород как таковой. В природе, синглетный кислород обычно образуется из воды при фотосинтезе, используя энергию солнечного света. Он также образуется в тропосфере путем фотолиза озона светом короткой длины волны и иммунной системой в качестве источника активного кислорода. Каротиноиды в фотосинтезирующих организмах (и, возможно, животных) играют важную роль в поглощении энергии из синглетного кислорода и превращении его в невозбужденное основное состояние до того, как оно может нанести вред тканям. 11)