Металлическому изделию можно придать блеск различными способами. Для этого не обязательно использовать специальные покрытия, можно воспользоваться методом полировки. Она может быть механической, например, с помощью наждачных кругов, химической — когда металл погружают в специальный раствор, а также электрохимической. В этом случае сочетается воздействие химических компонентов и электроразрядов, которые запускают определенные реакции или усиливают их. Электрохимическая полировка металлов может быть выполнена и в обычных домашних условиях, если собрать все необходимое оборудование.
Описание процесса
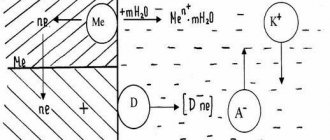
Во время электрохимического полирования обрабатываемая поверхность металла приобретает зеркальный блеск. Также уменьшаются имеющиеся шероховатости. Процесс происходит следующим образом:
- Деталь считается анодом, то есть, электродом, несущим положительный заряд. Ее необходимо поместить в ванну со специальным составом.
- Еще один важный компонент — катоды, которые необходимы для осуществления реакции.
- В результате воздействия протекает реакция, и происходит растворение. Оно неравномерно, сначала удаляются самые заметные шероховатости, которые выступают над поверхностью больше всего. Одновременно происходит полировка — изделие приобретает зеркальный блеск.
Удаление заметных больших неровностей называется макрополированием, а сглаживание мелких дефектов — это микрополирование. Если эти процессы во время проведения обработки протекают одновременно и равномерно, то изделие приобретает блеск и гладкость. Возможно и такое, что блеск будет получен без сглаживания или наоборот. Два вида полирования не обязательно связаны.
Химическая полировка металла приводит к тому, что на поверхности обрабатываемой детали во время процесса образуется особая пленка. По составу она может быть оксидной или гидроксидной. Если она равномерно охватывает всю поверхность, это создает условия для микрополирования. При этом внешняя часть покрытия, располагающаяся на поверхности, непрерывно растворяется. Чтобы получить возможность провести микрополирование, необходимо обеспечить поддержание равновесия между непрерывным образованием покрытия и растворением, во время работы с деталью толщина слоя должна оставаться неизменной. Это позволит электронам обрабатываемого металла и применяемого состава в процессе взаимодействовать без опасности растворения металлического изделия в агрессивной среде.
Химическая полировка железа
Здесь: https://old-rvs.itsoft.su/article/sart.html…9&conf_id=5 рассмотрено влияние примесей (углерод, хром, никель и т.п.) на растворимость водорода в железе. Выдержка из текста:
При 0,5% С (по массе) абсорбционная емкость сплава достигает минимума, после чего дальнейшее повышение концентрации углерода сопровождается ростом растворимости водорода . Максимальной растворимостью обладают сплавы, содержащие 1,5… 2,0% углерода.
В чистом железе до температуры плавления растворение водорода сопровождается значительным поглощением тепла. Это указывает на рост растворимости водорода в металле с повышением температуры, почему я советовал прогревать детали в вакууме (причем сперва надо дать вакуум, а потом начать нагрев). В сталях углерод понижает растворимость водорода при температурах до 7000С, при этом диффузионная подвижность его также снижается.
«Влияние хрома на растворимость водорода в сплавах с железом по своему характеру различно в α- и γ- фазах. При температурах 400… 9000C хром несколько уменьшает растворимость водорода в феррите, но увеличивает в аустените. Это же наблюдается и в хромистых и хромоникелевых сталях. В хромистом феррите диффузионная подвижность прогрессивно убывает с увеличением содержания хрома в железе . Напротив, в аустенитном состоянии с увеличением хрома в железе диффузионная подвижность водорода не чувствительна к росту концентрации хрома. В сталях с 19% (по массе) хрома при 200… 6000С наблюдается резкое уменьшение скорости диффузии водорода . Повышение концентрации хрома до 28% практически не влияет на скорость диффузии водорода . Малые добавки хрома (до 3%) снижают скорость диффузии водорода . Аналогичный эффект влияния хрома наблюдается и в сталях 34ХН3М и 20Х2Н4А; 40, 40Х и 35Х3.
Растворимость водорода в железоникелевых сплавах растет с увеличением в них никеля до 18% (по массе) и повышении температуры от 350 до 9000С. Диффузионная подвижность водорода в никелевом аустените не зависит от концентрации никеля. В более широком диапазоне концентраций от 2 до 98% Ni и температур от 200 до 6000С влияние никеля на диффузионную подвижность водорода носит сложный характер. Добавки никеля до 6% повышают скорость диффузии водорода в сплавах, в то время как большие (до 75%) ее понижают. Такое влияние связывается с образованием интерметаллида Ni3Fe. Это характерно и для низколегированных никелем сталей – 34ХМ; 34ХН2М и 34ХН3М; 40Х и 40ХН. Скорости диффузии водорода в никелевом аустените и марганцевом аустените близки, слабо зависят от состава и совпадают с диффузией водорода в аустенитных сталях – 1Х18Н9Т и 30Х10Г10.
Растворимость водорода в кремнистом железе с содержанием кремния до 1,5% (по массе) слабо возрастает, а затем при 7,8% Si быстро убывает. При температурах 400… 9000С с ростом содержания кремния в феррите растворимость водорода плавно увеличивается. Диффузионная подвижность водорода мало меняется с ростом содержания кремния до 0,5% и сильно снижается при концентрации кремния выше 7,8%.
Марганец при температурах 400… 9000С и содержании его в железе до 35% в зависимости от концентрационно-температурных условий может либо уменьшать растворимость водорода , либо увеличивать ее. Это объясняют внутрифазовым наклепом и фрагментацией зерен. Резкое снижение растворимости при содержании марганца 10… 20% связано с образованием ε – фазы. Скорость диффузии водорода в углеродистых сталях с ростом концентрации в них марганца от 0,5 до 4% уменьшается. Небольшие количества марганца понижают скорость диффузии водорода в сталях – 38НСА и 35ХГСА; 40ХН и 38ХГН. Марганец повышает энергию активации диффузии водорода .
Предварительная деформация, механическая и термическая обработка конструкционных сталей оказывают сильное влияние на растворимость и диффузионную подвижность водорода [8].
Рассмотренные эффекты влияния легирующих элементов и структуры на поведение водорода в сталях позволяют предположить пути снижения склонности сталей к водородному изнашиванию.
К факторам, снижающим склонность конструкционных сталей к водородному изнашиванию, можно отнести следующие:
1. Легирующие элементы в сталях не должны повышать растворимость и диффузионную подвижность водорода .
2. Фазовый состав стали должен обладать минимальной абсорбционной емкостью.
3. Термовакуумная обработка деталей для удаления растворенного в металле водорода .
4. Применение технологических процессов изготовления деталей, исключающих наводороживание.
5. Стабильность микроструктуры стали при работе узла трения.
6. Высокая пластичность стали.
7. Мелкозернистость или тонкопластинчатое строение микроструктуры.
8. Равномерно распределенные мягкая и твердая составляющие структуры.
Если именно изнашивание не играет особой роли, я бы остановился на пунктах 1, 2, и3 .
Литература
1. Костецкий Б.И. и др. Надежность и долговечность машин. Киев: «Техника», 1975.
2. Коттерилл П. Водородная хрупкость металлов. М.: Металлургиздат, 1963.
3. Карпенко Г. В ., Крипякевич Р.И. Влияние водорода на свойства стали. М.: Металлургиздат, 1962.
4. Колачев Б.А. Водородная хрупкость цветных металлов. М.: «Металлургия», 1966.
5. Гельд П. В ., Рябов Р.А. Водород в металлах и сплавах, М.: «Металлургия», 1974.
6. Черепанов Г.П. Механика хрупкого разрушения. М.: «Наука», 1974.
7. Стеклов О.И. Прочность сварных конструкций в агрессивных средах. М.:
«Машиностроение», 1976.
8. Справочник по машиностроительным материалам. Сталь, том 1, под ред. Ю.А. Геллера. М.: «Машиностроение», 1962.
Оборудование и химикаты
Для работы с различными металлами необходимо подобрать соответствующие электролиты, которые помогут добиться нужного результата:
- Чаще всего применяются составы на основе кислоты различного вида — серной, фосфорной или хромовой.
- Глицерин может быть добавлен для увеличения общей вязкости, если это потребуется.
- Сульфоуреид выступает в роли ингибитора травления.
- Для очистки различных изделий после проведения процедуры могут применяться различные растворители или щелочные средства. Нередко используются составы с поверхностно-активными действующими веществами.
Приготовление электролита для электрополировки
Приготовление электролита электрополировки очень простое и состоит в растворении хромового ангидрида в ванне, заполненной рассчитанным количеством воды, в которую затем последовательно небольшими порциями (во избежание резкого разогрева и выброса) приливают серную и ортофосфорную кислоты.
Полученный таким образом раствор подвергают нагреву и выдержке при температуре 100 … 110С до тех пор, пока его плотность (при 20С) не уложится в диапазон 1,72±0,02 г/см3. Если по каким-либо причинам такая температура недостижима, то для получения электролита с требуемой плотностью его прорабатывают током из расчета 5 А·час/л при анодной плотности тока 25 А/дм2.
Расчет количества химикатов, необходимых для приготовления 1 л электролита Количество H3PO4, потребное для составления 1 л электролита определяется по формуле:
Количество H2SO4 для тех же целей:
Количество хромового ангидрида CrO3:
В этих формулах приняты следующие обозначения: a1 – весовое процентное содержание H3PO4 в готовом электролите полирования (см. табл. 1); d – плотность готового электролита, г/см3; b1 – концентрация используемой H3PO4, вес.%; d1 – плотность используемой H3PO4, г/см3; a2 – концентрация H2SO4 (см. табл. 1), вес.%; b2 – концентрация используемой H2SO4, вес.%; в2 – плотность используемой H2SO4, г/см3; a3 – концентрация хромового ангидрида (см. табл. 1), вес.%.
Величины b1, b2, d1, d2 определяют по справочным таблицам.
Пропорции создания хим состава
Полировка проводится в специальных ваннах. Важно помнить, что их составляющие относятся к токсичным веществам и опасны для здоровья, особенно если используется нагрев, поэтому обращаться со всеми компонентами необходимо с максимальной осторожностью, соблюдая положенную технику безопасности.
Изделия из цветных или черных металлов можно обрабатывать при помощи универсального состава, который окажет необходимое воздействие. Для этого следует добавить все компоненты, соблюдая пропорции. Ортофосфорная кислота составляет основу — 65%. Серной кислоты должно быть 15% и 14% обычной воды. Хромовый ангидрид занимает 6%.
Преимущества электрохимической полировки
Электрохимическое полировка стали, как, впрочем, и химическая, менее трудоемка, чем механическое полирование. Одновременно этим способом может полироваться большое количество деталей, имеющих самую различную форму и габариты, что невозможно при ручной механической обработке полировальными кругами, которые, кстати, можно изготовить самыми разнообразными способами, на любой вкус. Важно при этом правильно подобрать полировальную пасту, обеспечивающую минимальный съем металла при высоком качестве обработки. Электрополирование дает возможность повысить производительность труда, например, трудоемкость ручного полирования при немеханизированной доводке прессформ сложного профиля составляет 25 часов, а электрохимполировки всего — 15 … 25 минут.
Полировка нержавеющих сталей, которая особенно эффектно смотрится на изделиях, подвергнутых рельефному травлению, еще более трудоемка вследствие их вязкости. Высококачественную зеркальную полировку нержавеющей стали обеспечивает электрохимический способ.
Качество полирования при использовании электрохимического способа превосходит качество обработки химическим способом, что обеспечивает его преимущественное применение при декоративной отделке деталей велосипедов, медицинской аппаратуры, ювелирных изделий. Особенно высок эффект электрополировки в ювелирном производстве, поскольку при этом сведены к минимуму безвозвратные потери драгоценных металлов.
Тематические рамки статьи не позволяют в полной мере раскрыть влияние других компонентов (кроме ортофосфорной и серной кислот) на качество электрополирования, однако стоит вкратце остановиться на одном из них – малеиновом ангидриде. Добавка его в количестве 10 … 20 г/л нивелирует ликвации и гетерогенность структуры поверхности стальных литых и термообработанных деталей, создает благоприятные условия для возникновения пассивной пленки, что в конечном итоге дает возможность получать высококачественные полированные поверхности.
Преимущества и недостатки
Разные виды полировки имеют свои особенности, у электрохимической также есть плюсы и минусы:
- Этот способ благоприятно влияет на все свойства стали, увеличивая устойчивость к воздействию коррозии, а также облегчая проведение вытяжки и штамповки. Именно поэтому полировку такого типа часто используются как в лабораторных исследованиях, так и непосредственно для проведения различных работ в промышленности.
- Электрохимическая полировка является более дешевым и быстрым способом обработки металлических изделий. Если механический метод занял бы несколько часов, то с воздействием химикатов и электричества можно закончить дело за несколько минут, получив качественный результат.
- Полировка с электрохимическим воздействием незаменима при работе со сложными деталями, которые имеют различные полости и отверстия.
Химическая полировка металлов кроме преимуществ, имеет некоторые недостатки. Практически каждый существующий металл требует для проведения работы с ним специального состава, поэтому для разных изделий необходимо делать индивидуальные растворы. Также важно правильно подобрать соотношение компонентов, температуру нагрева, плотность тока — от этого напрямую зависит качество полученного результата. Перед проведением такой обработки может потребоваться предварительное механическое шлифование. Кроме того, процедура требует повышенного расхода электроэнергии. Однако при определенных условиях достоинства метода вполне перевешивают его недостатки, позволяя проводить полировку.
Отличия электрополирования от химического
Электрополирование, как и электроплазменная обработка, отличается от химического процесса тем, что через электролит подается электрический ток.
При химическом полировании изделие опускается в емкость с химическим раствором кислоты или щелочи. Здесь происходит растворение поверхностного слоя. Это сопровождается бурным кипением содержимого сосуда. Деталь приобретает нужную шероховатость за несколько секунд. В отличие от электрополирования такой метод менее затратный. Здесь не требуется сложного оборудования. Но присутствуют и недостатки:
- Сложность контроля над протеканием процесса.
- Без применения электрического тока качество получаемого изделия ниже. У него отсутствует блеск. Поэтому такому способу обработки больше подвергаются изделия из цветного металла, имеющие сложную конфигурацию, которым не предъявляется высоких требований.
Свойства металла после пассирования
Данная процедура приводит к образованию на поверхности металла химически стабильного слоя, устойчивого к коррозии. Изделия из пассивированного металла имеют более длительный срок службы. Если пассирование проводилось с использованием хроматов, то их поверхность, ко всему прочему, будет обладать повышенной устойчивостью к механическим воздействиям. Нужно отметить, что у оксидного слоя есть свой предел прочности и его механическое повреждение приводит к последующему появлению коррозии.