Пропан, получение, свойства, химические реакции.
Пропан, C3H8 – органическое вещество класса алканов. В природе содержится в природном газе, добываемом из газовых и газоконденсатных месторождений, в попутном нефтяном газе. Образуется также при крекинге нефтепродуктов.
Пропан, формула, газ, характеристики
Физические свойства пропана
Химические свойства пропана
Получение пропана
Химические реакции – уравнения получения пропана
Применение и использование пропана
Применение
Благодаря своим свойствам, таким как высокая теплотворная способность при сгорании, сгорание без остатка, безвредность и безопасность при правильной эксплуатации, удобство в использовании, пропан является универсальным газом и широко используется и на производстве, и в быту. Для производственных и бытовых целей поставляется в виде смеси пропан-бутановой технической. Бутан (C4h20) — органическое соединение класса алканов. На сегодняшний день спрос на СПБТ огромен.
На производстве При выполнении газопламенных работ на заводах и предприятиях: – в заготовительном производстве; – для резки металлолома; – для сварки неответственных металлоконструкций. При кровельных работах. Для обогрева производственных помещений в строительстве. Для обогрева производственных помещений (на фермах, птицефабриках, в теплицах). Для газовых плит, водогрейных колонок в пищевой промышленности. В быту – при приготовлении пищи в домашних и походных условиях; – для подогрева воды; – для сезонного обогрева отдалённых помещений – частных домов, отелей, ферм; – для сварки труб, теплиц, гаражей и других хозяйственных конструкций с использованием газосварочных постов.
В последнее время широко используется в качестве автомобильного топлива, т.к. дешевле и экологически безопаснее бензина. В химической промышленности используется при получении мономеров для производства полипропилена. Является исходным сырьём для производства растворителей. В пищевой промышленности пропан зарегистрирован в качестве пищевой добавки E944, как пропеллент.
Хладагент. Смесь из осушенного чистого пропана (R-290a) (коммерческое обозначение для описания изобутаново-пропановых смесей) с изобутаном (R-600a) не разрушает озонового слоя и обладает низким коэффициентом парникового потенциала (GWP). Смесь подходит для функционального замещения устаревших хладагентов (R-12, R-22, R-134a) в традиционных стационарных холодильных установках и систем кондиционирования воздуха.
Показатели качества газов углеводородных сжиженных определяются по ГОСТ 10157-79.
Пропан, формула, газ, характеристики:
Пропан (лат. propanum) – органическое вещество класса алканов, состоящий из трех атомов углерода и восьми атомов водорода.
Химическая формула пропана C3H8, рациональная формула CH3CH2CH3. Изомеров не имеет.
Строение молекулы:
Пропан – бесцветный газ, без вкуса и запаха. Однако в пропан, используемый в качестве технического газа, могут добавляться одоранты – вещества, имеющие резкий неприятный запах для предупреждения его утечки.
В природе содержится в природном газе, добываемом из газовых и газоконденсатных месторождений, в попутном нефтяном газе. Для выделения из природного и попутного нефтяного газа производят их очистку и сепарацию газа.
Образуется также при крекинге нефтепродуктов., в т.ч. сланцевой нефти.
Также содержится в сланцевом газе и сжиженном газе (сжиженном природном газе).
Пожаро- и взрывоопасен.
Не растворяется в воде и других полярных растворителях. Зато растворяется в некоторых неполярных органических веществах (метанол, ацетон, бензол, тетрахлорметан, диэтиловый эфир и другие).
Пропан
по токсикологической характеристике относится к веществам 4-го класса опасности (малоопасным веществам) по ГОСТ 12.1.007.
Пропан. Все аспекты применения в быту и производстве технического газа пропана
Современный уровень развития технического прогресса позволяет людям использовать для решения своих повседневных задач самые различные энергоносители. Одним из таких ресурсов является технический газ пропан. Этот газ знаком абсолютно всем современным людям. Пропан сегодня применяется практически повсеместно. В первую очередь это касается производственных процессов. Так, технический газ пропан с успехом применяется для производства газопламенных работ на различных производственных объектах. С его помощью производят как резку металла, так и сварку неответственных конструкций. При работе с металлоломом этот газ практически незаменим для заготовки сырья. Это связанно с тем, что остальные технические газы для сварочных работ стоят на порядок дороже и не позволяют оптимизировать расходы на производстве.
С не меньшим успехом пропан применяется и при производстве тепловой энергии. В последующем тепло, полученное при помощи технического газа пропана, используется для обеспечения теплоснабжения, как производственных помещений, так и для подачи тепла в жилые комплексы.
В быту газ пропан находит свое применение в самых различных сферах деятельности человека. Самым распространенным способом применения этого газа является использование его в качестве энергоносителя для газовых плит и газовых колонок. С его помощью человек готовит пищу, нагревает воду. Также в индивидуальном секторе жилья пропан используется для организации отопления помещений. Для этого устанавливается специальное оборудование. Газ пропан в жилые помещения подается с помощью газопроводов. В некоторых случаях также может иметь место доставка сжиженного пропана в специальных баллонах.
В последнее время пропан в бытовых условиях нашел еще одно свое применение. Его используют в качестве автомобильного топлива. Для этого автотранспортное средство оснащается комплектом оборудования, которое позволяет использовать этот технический газ для работы двигателя. Данный вид оптимизации приводит к значительной экономии денежных средств автомобилиста. Также существенно снижается уровень выброса вредных веществ от сгорания топлива в атмосферу.
Стоит знать – что собой представляет газ пропан, каковы его преимущества и недостатки. Прежде всего, стоит отметить, что технический газ пропан является синтетическим продуктом. Его часто называют природным газом. В части это утверждение верно. Действительно, пропан производится на основе природного газа, который является остаточным продуктом процесса добычи нефти. Это так называемый, сопутствующий газ.
По своим свойствам газ пропан практически ничем не отличается от природного газа. Он имеет высокое октановое число. Также обладает отличными экологическими и эксплуатационными показателями. Пропан, который поставляется потребителям для использования, находиться в сжиженном состоянии. Для того чтобы обеспечить сжиженное состояние газа, его хранят и перевозят под высоким давлением. При этом следует знать, что, если пропан поставляется в баллонах, то степень наполненности емкости не должна превышать 90%. Это обеспечит высокий уровень безопасности применения пропана в бытовых и производственных целях.
Газ пропан – не является ядовитым отравляющим веществом. Он достаточно безопасен для применения, если соблюдаются все требования технической эксплуатации. Так, баллоны с пропаном не должны храниться в жилых помещениях. При их хранении следует обеспечивать отсутствие открытых источников тепла и воздействия солнечного света. Газопроводы должна выполняться из стальных бесшовных труб.
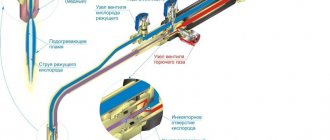
При производстве сварочных работ технический газ пропан используется в смеси с кислородом. Этот газ с успехом заменяет в сварке ацетилен. При этом несомненным преимуществом пропана является его более низкая себестоимость и повсеместная доступность. Однако есть и недостатки.
В частности, температура горения пропана почти на тысячу градусов ниже температуры горения ацетилена. Это создает определенные трудности в ходе сварочных работ. Есть такие участки работ, на которых применение пропана для газопламенных работ может существенно снизить качество произведенных работ. Сварка металлических деталей с толщиной выше шести миллиметров при помощи пропана будет крайне затруднительна.
К основным недостаткам сварки при помощи пропана можно отнести такие побочные эффекты, как большой процент деформации детали, наличие крупных зерен в самом шве и околошовном пространстве. Достаточно сложно при этом и отрегулировать факел горелки. Для того, чтобы правильно настроить восстановительный, окислительный или нормальный режим горелки для применения пропана, сварщику необходимо обладать большим опытом таких работ.
Для сварки с помощью технического газа пропана используются только инжекторные газовые горелки. Сегодня практически все виды предлагаемых на рынке сварочного оборудования горелки и резаки, являются инжекторными. Поэтому особых проблем с выбором подходящего сварочного оборудования для производства обработки металлов с помощью пропана у сварщика не возникнет.
История применения пропана в быту и производстве насчитывает внушительный период времени. Пропан входит в нашу жизнь с каждым годом все более тесно. Этот газ будет применяться еще долгое время. Это связано с его экономичностью, высокими потребительскими свойствами и доступностью для широкого круга потребителей.
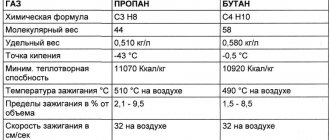
Физические свойства пропана:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | без запаха |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м3 | 1,8641 |
| Плотность (при температуре кипения и атмосферном давлении 1 атм.), кг/м3 | 585 |
| Температура плавления, °C | -187,6 |
| Температура кипения, °C | -42,09 |
| Температура самовоспламенения, °C | 472 |
| Критическая температура*, К | 370 |
| Критическое давление, МПа | 4,27 |
| Критический удельный объём, м3/кг | 0,00444 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 1,7 до 10,9 |
| Удельная теплота сгорания, МДж/кг | 48 |
| Молярная масса, г/моль | 44,1 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
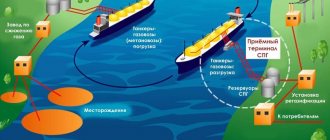
Два способа получения сжиженного газа
Газ можно превратить в жидкость двумя способами:
- путем понижения температуры;
- путем сжимания под высоким давлением.
Все газы конденсируются в жидкость естественным образом, когда его температура понижается ниже температуры кипения. Однако из-за того, что эти температуры часто очень низкие, требующие больших усилий для их создания и поддержания, чаще используется метод создания высокого давления. Когда газ искусственно сжимается большим давлением, он тоже может принять жидкую форму. Однако это справедливо не для всех веществ.
Химические свойства пропана:
Пропан трудно вступает в химические реакции. В обычных условиях не реагирует с концентрированными кислотами, расплавленными и концентрированными щелочами, щелочными металлами, галогенами (кроме фтора), перманганатом калия и дихроматом калия в кислой среде.
Химические свойства пропана аналогичны свойствам других представителей ряда алканов. Поэтому для него характерны следующие химические реакции:
- 1. каталитическое дегидрирование пропана:
CH3-CH2-CH3 → CH2=CH-CH3 + H2 (kat = Pt, Ni, Al2O3, Cr2O3, to = 575 °C).
- 2. галогенирование пропана:
CH3-CH2-CH3 + Br2 → CH3-CHBr-CH3 + HBr (hv или повышенная to);
CH3-CH2-CH3 + I2 → CH3-CHI-CH3 + HI (hv или повышенная to).
Реакция носит цепной характер. Молекула брома или йода под действием света распадается на радикалы, затем они атакуют молекулы пропана, отрывая у них атом водорода, в результате этого образуется свободный пропил CH3-CH·-CH3, который сталкиваются с молекулами брома (йода), разрушая их и образуя новые радикалы йода или брома:
Br2 → Br·+ Br· (hv); – инициирование реакции галогенирования;
CH3-CH2-CH3 + Br· → CH3-CH·-CH3 + HBr; – рост цепи реакции галогенирования;
CH3-CH·-CH3 + Br2 → CH3-CHBr-CH3 + Br·;
CH3-CH·-CH3 + Br· → CH3-CHBr-CH3; – обрыв цепи реакции галогенирования.
Галогенирование — это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атомы галогенируются в последнюю очередь). Галогенирование пропана проходит поэтапно – за один этап замещается не более одного атома водорода.
CH3-CH2-CH3 + Br2 → CH3-CHBr-CH3 + HBr (hv или повышенная to);
CH3-CHBr-CH3 + Br2 → CH3-CBr2-CH3 + HBr (hv или повышенная to);
и т.д.
Галогенирование будет происходить и далее, пока не будут замещены все атомы водорода.
- 3. нитрование пропана:
См. нитрование этана.
- 4. окисление (горение) пропана:
При избытке кислорода:
C3H8 + 5O2 → 3CO2 + 4H2O.
Горит желтым пламенем.
При нехватке кислорода вместо углекислого газа (СО2) получается оксид углерода (СО), при еще меньшем количестве кислорода выделяется мелкодисперсный углерод (в различном виде, в т.ч. в виде графена, фуллерена и пр.) либо их смесь.
- 5. сульфохлорирование пропана:
C3H8 + SO2 + Cl2 → C3H7-SO2Cl + … (hv).
- 6. сульфоокисление пропана:
2C3H8 + 2SO2 + О2 → 2C3H7-SO2ОН (повышенная to).
Преимущества сжиженного газа
Преобразование газов в жидкую форму помогло решить проблему транспортировки и хранения газов. Хранить жидкости удобнее, чем газы, поскольку для этого не требуется полностью герметичных помещений. Существенно уменьшается и занимаемый объем: для метана он сокращается в 600 раз.
Сжиженный газ легче доставлять и заправлять, особенно это касается пропана, бутана, их смеси, а также углекислого газа. Подробнее о том, как происходит заправка углекислотных баллонов, можно узнать на этой странице сайта «ТОРГГАЗ».
Однако метан по-прежнему используется преимущественно в газообразной форме из-за развития трубопроводной технологии в нефтедобывающей промышленности.
Получение пропана. Химические реакции – уравнения получения пропана:
Так как пропан в достаточном количестве содержится в природном газе, попутном нефтяном газе и выделяется при крекинге нефтепродуктов, его не получают искусственно. Его выделяют при очистке и сепарации из природного газа, ПНГ и нефти при перегонке.
Пропан в лабораторных условиях получается в результате следующих химических реакций:
- 1. гидрирования непредельных углеводородов, например, пропена:
CH3-CH=CH2 + H2 → CH3-CH2-CH3 (kat = Ni, Pt или Pd, повышенная to).
- 2. восстановления галогеналканов:
C3H7I + HI → C3H8 + I2 (повышенная to);
C3H7Br + H2 → C3H8 + HBr.
- 3. взаимодействия галогеналканов с металлическим щелочным металлом, например, натрием (реакция Вюрца):
C2H5Br + СH3Br + 2Na → CH3-CH2-CH3 + 2NaBr;
C2H5CI + СH3Cl + 2Na → CH3-CH2-CH3 + 2NaCl.
Суть данной реакции в том, что две молекулы галогеналкана связываются в одну, реагируя с щелочным металлом.
- 4. декарбоксилирования масляной кислоты и ее солей:
C3H7-COOH + NaOH → C3H8 + Na2CO3 (повышенная to);
C3H7-COONa + NaOH → C3H8 + NaHCO3.
Меры безопасного использования
При контакте с воздухом пропан в сжиженном виде способен образовывать взрывоопасную смесь. Максимально допустимым значением считается показатель содержания пропана в воздухе рабочей зоны, не превышающий 300 мг/м³. Неприемлемо наличие источников пламени в помещениях, в которых присутствует даже незначительный запах газа. Пропан тяжелее воздуха, а потому он может оседать и накапливаться в помещениях с плохой вентиляцией. Исключено попадание газа на открытый участок кожи – воздействие сжиженного углеводорода вызывает обморожение, влекущее повреждение тканей.
При работе с пропаном следует соблюдать меры индивидуальной защиты органов дыхания – вдыхание пропана оказывает на организм человека одурманивающее действие (головокружение, опьянение, потеря сознания). Газу свойственно накопление в организме и быстрый вывод, без аккумуляции во внутренних органах.
Предыдущая статьяЧто необходимо знать об ацетилене?
Следующая статьяСостав и особенности сварочных смесей
Пропан-бутановая смесь
Она имеет много преимуществ перед другими видами топлива, в том числе природным газом:
- высокий КПД;
- легкий возврат к газообразному состоянию;
- хорошие испарение и сжигание при окружающей температуре.
Пропан в полной мере отвечает этим качествам, а вот бутаны несколько хуже испаряются при понижении температуры до -40°С. Исправить этот недостаток помогают добавки, лучшая из которых — это пропан.
Пропан-бутановую смесь применяют для отопления и приготовления пищи, при газовой сварке металлов и их резке, как топливо для транспортных средств и для химического синтеза.