Историческая справка
Само название «цинк» впервые было упомянуто в книге « Liber Mineralium » Парацельса. По некоторым данным оно означало «зубец». Сплав цинка с медью или латунь известен давно. Его применяли в Древней Греции, Индии и Древнем Египте, позднее материал стал известен в Китае. В чистом виде металл удалось получить лишь в первой половине XVIII века в 1738 году в Великобритании при помощи дистилляционного способа. Его открывателем стал Уильям Чемпион. Промышленное производство началось через 5 лет, а в 1746 году в Германии химик Андреас Сигизмунд Маргграф разработал и в деталях описал собственный способ получения цинка. Он предлагал использовать метод прокаливания смеси окиси металл с углем в огнеупорных ретортах из глины без доступа воздуха. Последующая конденсация паров должна была проходить в холодильнике. Из-за подробного описания и кропотливых разработок Маргграфа часто называют первооткрывателем вещества.
В начале XIX века был найден способ выделения металла путем прокатки при 100 C о-150 C о. В начале следующего века научились добывать цинк электролитическим способом. В России первый металл получили только в 1905 году.
Нахождение в природе
Всего ученые насчитывают около 66 минералов цинка или его производных. Этот металл научились смешивать с другими элементами, тем самым получая разнообразные смеси и различные цвета.
Первичным минералом считается так называемая цинковая обманка, которая была обнаружена еще в Древней Греции.
В природе она встречается в виде смеси с бурым шпатом.
В земной коре содержится около 10% цинка. Также его можно найти в извергаемых земных породах. В кислых содержится значительно меньше. Также в природе встречается и гидроксид цинка. Всего насчитывается 5 его модификаций.
Цинк имеет свойство мигрировать в термальных водах. Кроме того, его можно обнаружить и в подземных и поверхностных водах, где он также успешно мигрирует.
Ученые выяснили, что и в живых организмах находится относительно большое количество цинка. Он необходим им для успешной жизнедеятельности.
Меры предосторожности в применении цинка
При чрезмерном употребления цинка могут начаться серьезные проблемы!
Даже полностью несбалансированное питание не может спровоцировать существенный избыток цинка. Зачастую превышение нормальной его концентрации вызывается приемом лекарственных препаратов, а также БАДов, которые содержат цинк в своем составе. Явного избыток цинка наблюдается у пациентов, которые принимали более 150 мг цинка в день.
Вторая вероятная причина избытка цинка в организме — это большое количество поступления цинка в организм, к примеру, в процессе контакта с соединениями микроэлемента в условиях производства. В некоторых случаях опасность может представлять упаковка некоторых напитков и продуктов. Так, зафиксированы случаи отравления цинком в результате употребления пищи, которая хранилась в цинковых или в оцинкованных контейнерах.
Чрезмерное потребление цинка также может быть вредно. В этом случае возможно понижение уровня хорошего холестерина (HDL) и, как следствие, увеличение вероятности развития сердечно-сосудистого заболевания.
Более того, избыточное количество цинка в течение продолжительного периода времени может привести к нарушению минерального баланса и вызвать изменения веществ, участвующих в кальциевом обмене: кальцитонина, гормона, увеличивающего запасы кальция в костях и остеокальцина, важнейшего белка, необходимого для укрепления кости.
Симптомы избытка цинка:
- Снижение работы иммунной системы, развитие аутоиммунных реакций;
- патологические состояния ногтей, кожи, волос;
- боли в области желудка, тошнота;
- понижение уровня кадмия, меди, железа в организме;
- нарушения работы печени, поджелудочной железы, простаты;
- давящая боль в груди, сухой кашель;
- озноб, сонливость.
Биологическая роль цинка
У взрослого человека в организме содержится определенное количество цинка, а именно около 2 г. В человеческом организме он содержится в качестве органических соединений, которые находятся в мышечной ткани, поджелудочной железе и печени.
Цинк очень полезен для человека, а его недостаток обычно определяет появление различных заболеваний и патологий. Множество ферментов в человеческом организме содержат данный элемент.
Биологически цинк нужен организму для:
- выработки мужских половых гормонов, в частности, спермы;
- правильной деятельности простаты;
- метаболизма витаминов и питательных веществ;
- синтеза гормонов;
- расщепления клеток алкоголя и ускорения выведения токсинов.
Польза данного элемента очень важна как для взрослых, так и для детей. Для аллергиков и людям с некоторыми заболеваниями хорошо подходят витамины в жидком виде, так как они хорошо усваиваются и для их производства не применяются консерванты. Существуют цинкосодержащие препараты как для взрослых, так и для детей.
Важно помнить, что переизбыток цинка так же вреден, как и недостаток.
Поэтому крайне важно следить за правильными пропорциями.
Цинк и сталь
Практически в каждом доме можно встретить оцинкованные вещи: ведра, кастрюли, выварки и пр. Все они надежно защищены от ржавчины именно благодаря цинку. Образно выражаясь, конечно, на сталь наносится напыление этого металла, и по логике вещей речь не идет о сплаве. С другой стороны, зная, как происходит оцинкование, можно утверждать обратное. Дело в том, что цинк плавится при очень низкой температуре (около 400°С), а когда он в жидком состоянии попадает на поверхность стали, то диффундирует в неё.
Атомы обоих веществ очень крепко связываются между собой, образуя железоцинковый сплав. По этой причине можно смело сказать, что Zn не «уложен» на изделие, а «внедрен» в него. Это можно наблюдать в обычной бытовой ситуации. К примеру, на оцинкованном ведре появляется царапина. Начинает ли оно в этом месте ржаветь? Ответ однозначный – нет. Это происходит потому, что при попадании влаги начинают разрушаться соединения цинка, но при этом они образуют некую защиту для стали. Так, в большинстве случаев такие цинковые сплавы предназначены для защиты изделий от коррозии. Конечно, для этих целей можно использовать и другие вещества, такие как хром или никель, но стоимость этих изделий будет в разы больше.
Интересные факты
Интересных фактов связанных с цинком достаточно много. Стоит начать с того, что цинк является одним из незаменимых микроэлементов в организме человека. Он играет важную роль в обмене веществ. Суточная норма потребления цинка для взрослых мужчин составляет 15 мг, женщин — 12 мг, детей — 10 мг и 5 мг для младенцев. При передозировке цинка может возникнуть цинковая лихорадка. Ее симптомы напоминают грипп, но через 2 — 3 дня симптомы проходят. На конференции общественного питания в Сан-Диего была озвучена интересная заметка. У детей которые принимали вдвое больше цинка(порядка 20мг в день), значительно улучшились умственные способности. Это выражалось в усилении зрительной памяти и повышенной концентрации внимания.
Еще одним интересным моментом является то, что на богатой цинком почве растут редкие растения. В пример можно привести галилейскую фиалку. Если количество таких фиалок большое, это может означать что в этом месте расположено месторождение цинка.
Цинк: применение
Формы выпуска цинка
Таблетки/Лепешки/Капсулы/Жидкость/
Особенности применения цинка
- В качестве общей добавки 30 мг в день.
- При угрях — 135 мг в день или 1,2%-ная мазь местно
- При желудочно-кишечных заболеваниях — 300 мг ацексамата цинка в день.
- При нарушениях вкуса — 100 мг в день
- При обычной простуде — 10-23 мг в виде лепешек через каждые 2 часа, но не больше 150 мг в день. Детям следует принимать 10 мг в день или 1 мг на 1 кг массы тела
- Для зубов 0,5%-ный цитрат цинка.
- Герпес 0,3%-ная мазь цинка
- Принимайте цинк за 1 час до еды или через 2 часа после нее. Если он вызывает раздражение желудка, принимайте его с пищей, содержащей малое количество клетчатки
- Не принимайте одновременно препараты железа и цинка
- Принимайте лекарство не раньше чем через 2 часа после приема антибиотиков
- При приеме цинка дольше 1 месяца может нарушаться усвоение меди, поэтому на каждые 30 мг цинка добавляйте 2 мг меди.
Токсичность цинка
Переизбыток данного микроэлемента очень вреден для здоровья человека, так же как и его недостаток. Переизбыток цинка вызывает интоксикацию организма.
В особенности при длительном чрезмерном насыщении организма данным веществом, соли и сульфаты цинка отравляют человека своей токсичностью.
Сульфаты цинка образуются при неправильном хранении продуктов питания. Особенно вредно хранить продукты в закрытых емкостях из оцинкованной посуды.
Токсичность цинка вызывает даже бесплодие, импотенцию и другие проблемы со здоровьем. Можно отравиться им, вдыхая его пары. Проявляться такое отравление будет в виде головокружения, потери сознания, учащении пульса и появлении неприятного привкуса в ротовой полости.
Свойства цинковых сплавов
Конечно же, все составы с этим металлом отличаются между собой его процентным содержанием. В целом цинковые сплавы имеют хорошие литейные и механические свойства. Первое и самое главное – коррозионная стойкость. Больше всего она проявляется в атмосфере сухого чистого воздуха. Возможные проявления коррозии можно заметить в промышленных городах. Это обуславливается наличием в воздухе паров соляной кислоты, хлора и оксидов серы, которые, конденсируясь влагой, затрудняют образование защитной пленки. Медь-олово-цинк – сплав, который характеризуется высокими защитными свойствами. Именно такой состав наименее подвержен коррозии, особенно в условиях промышленной атмосферы. Если говорить о литейных свойствах цинка, то, конечно же, они зависят от легирующих элементов в его сплавах.
Так, например, алюминий делает их структуру однородной, мелкозернистой, облагораживает её, уменьшает отрицательное влияние железа. Еще один важный легирующий элемент – медь. Он увеличивает прочностные характеристики и уменьшает межкристаллическую коррозию. Медно-цинковый сплав обладает высокой ударной вязкостью, но при этом частично теряет свои литейные свойства.
Атом и молекула цинка. Формула цинка. Строение атома цинка:
Цинк (лат. Zincum, от нем. Zinke – «зубец») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Zn и атомным номером 30. Расположен в 12-й группе (по старой классификации – побочной подгруппе второй группы), четвертом периоде периодической системы.
Цинк – амфотерный металл. Относится к группе переходных металлов. Относится к цветным металлам.
Как простое вещество цинк при нормальных условиях представляет собой хрупкий металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
Молекула цинка одноатомна.
Химическая формула цинка Zn.
Электронная конфигурация атома цинка 1s2 2s2 2p6 3s2 3p6 3d10 4s2. Потенциал ионизации (первый электрон) атома цинка равен 906,4 кДж/моль (9,394197(6) эВ).
Строение атома цинка. Атом цинка состоит из положительно заряженного ядра (+30), вокруг которого по четырем оболочкам движутся 30 электронов. При этом 28 электронов находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку цинк расположен в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Четвертая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома цинка – на s-орбитали находится два спаренных электрона. В свою очередь ядро атома цинка состоит из 30 протонов и 35 нейтронов.
Радиус атома цинка (вычисленный) составляет 142 пм.
Атомная масса атома цинка составляет 65,38(2) а. е. м.
Цинк с давних пор широко используется человеком.
Химические, физические свойства и характеристики цинка
Цинк – металл, обладает рядом свойств и характеристик, отличающих его от иных элементов периодической таблицы.
К физическим свойствам цинка относится его состояние. Основным фактором выступает температурный режим. Если при комнатной температуре это хрупкий материал, плотность цинка 7130 кг/м3 (˃ плотности стали), который практически не гнётся, то при повышении он легко изгибается и прокатывается в листах на заводах. Если взять более высокий температурный режим – материал приобретает жидкое состояние, а если еще поднять температуру на 400-450 °С градусов, тогда он просто испарится. В этом уникальность – менять своё состояние. Если же подействовать кислотами и щелочами, он может рассыпаться, взорваться, расплавиться.
Цинк в жидком состоянии
Формула цинка Zn – zincum. Атомная масса цинка 65.382 а.е.м.
Электронная формула: ядро атома металла содержит 30 протон, 35 нейтрон. В атоме 4 энергетических уровня – 30 электронов. (рис. строение атома цинка)1s22s22p63s23p63d104s2.
Кристаллическая решётка цинка – шестиугольная кристаллическая система с плотно прижатыми атомами. Данные решётки: A=2.66У, С=4.94.
История
Сплав цинка с медью — латунь — был известен ещё в Древней Греции, Древнем Египте, Индии (VII в.), Китае (XI в.). Долгое время не удавалось выделить чистый цинк. В 1738 году в Англии был запатентован дистилляционный способ получения цинка. В промышленном масштабе выплавка цинка началась также в XVIII в.: в 1743 году в Бристоле вступил в строй первый цинковый завод, основанный Уильямом Чемпионом, где получение цинка проводилось дистилляционным способом. В 1746 А. С. Маргграф в Германии разработал похожий способ получения чистого цинка путём прокаливания смеси его оксида с углём без доступа воздуха в глиняных огнеупорных ретортах с последующей конденсацией паров цинка в холодильниках. Маргграф описал свой метод во всех деталях и этим заложил основы теории производства цинка. Поэтому его часто называют первооткрывателем цинка.
В 1805 году Чарльз Гобсон и Чарльз Сильвестр из Шеффилда запатентовали способ обработки цинка — прокатка при 100—150 °C . Первый в России цинк был получен на 1 января 1905 года. Первые заводы, где цинк получали электролитическим способом, появились в 1915 году в Канаде и США.
Получение цинка
Самостоятельно как металл в природе невозможно встретить данный элемент. Люди добывают его из руд, а затем обогащают и получают его концентраты. После получения производят обжиг в специальных печах, далее доводя его до необходимого состояния.
Основным способом получения этого металла считается электролитический способ.
Концентраты, полученные при обжигании в печи, обрабатывают специальным раствором, после чего тщательно очищают от различных примесей и подвергают электролизу.
Области применения цинка
Цинку выделяется отдельное место среди многих металлов промышленности. Он относится к числу молодых металлов.
Производить его стали в начале XIX века. Тогда объем производства составлял не более 900 тонн в год. Сегодня крупнейшими производителями цинка являются зарубежные страны (США, Канада, Австралия), на долю которых приходится 60 млн. тонн в год.
Итак, каково же применение цинка в промышленности?
О применении цинка расскажет это видео:
Основные сферы
Основными сферами применения цинка являются:
- Производство оцинкованной стали. Этой сфере соответствует половина (50%) от всего объема использования цинка.
- Изготовление бронзы и латуни. На эту сферу приходится примерно 20-25%.
- Изготовление сплавов на основе цинка.
- Производство химикатов. Самая маленькая по своему объему сфера расходования (всего 10%).
Как материал для конструкции нелегированный цинк не используется. Для этих целей он не обладает необходимыми технологическими, механическими и физическими свойствами.
В случае легирования, вышеперечисленные свойства существенно улучшаются. Поэтому очень часто цинк используют во время изготовления сплавов на основе алюминия, меди, свинца и латуни.
У цинка есть несколько марок. В зависимости от них металл может использоваться:
- Для оцинковки стали.
- Для изготовления цинковых сплавов.
- Для производства полуфабрикатов из цинка.
- Для изготовления цинковых соединений.
Продукция из металла
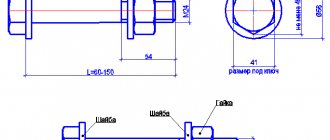
- Наиболее востребованными в строительстве и промышленности являются цинковые листы. Они бывают разными по толщине. Толщина самого тонкого листа может составлять 0,15 мм, а самого толстого – 1,5 мм и более. Цинковые листы часто используются при производстве оцинкованной посуды, сточных желобов и обычных труб.
- А так же цинковые листы хорошо применяют для изготовления печатных форм для типографии, для изготовления химических источников тока и кровельного покрытия.
С помощью напыления цинкосодержащих красок на самих строительных объектах обрабатываются сварные швы.
Способы оцинкования
На сегодняшний день существуют разные технологии нанесения цинка на поверхность изделий. Необходимо рассмотреть каждую из них подробно.
Горячий способ оцинкования
Металлическое изделие заранее обезжиривается, промывается и травится. Цинк плавят при температуре 450–480 °C. В жидкий металл опускается деталь. Принцип действия этого метода основан на том, что железо и его сплавы хорошо смачиваются. В результате образуется покрытие значительной толщины от 40 до 450 мкм, благодаря чему изделие надежно защищено от коррозии. Однако горячему способу присущи и недостатки. К ним относится:
- неравномерность толщины слоя;
- невозможность использовать метод для деталей, имеющих точный допуск, и в случае, когда под действием высокой температуры меняются характеристики крепежа.
Также есть вероятность, что после горячего оцинкования уменьшится прочность крепления, так называемое охрупчивание. Во избежание такой ситуации изделие необходимо обрабатывать термически после нанесения цинка, но даже это не дает полной гарантии. Рассматриваемый способ не подходит для деталей, покрытых лакокрасочными материалами или порошковыми красками. Причина заключается в низкой сцепляемости между ними и горячим цинком.
Обработка поверхности горячим цинком
Холодный способ оцинкования
У этого метода есть еще 2 названия: гальванический и электролитический. В данном случае технология напоминает процесс окрашивания изделия, но вместо красок используется специальный состав, содержащий цинк. В результате деталь покрывается антикоррозийным слоем. В отличие от предыдущего способа, подвергать холодному оцинковыванию можно крепеж любого размера и окрашенные изделия. С помощью данного метода достигается повышенная химическая стойкость. К слабым местам способа можно отнести малую толщину слоя – 5–35 мкм, что приводит к уменьшению антикоррозионных свойств. Рассматриваемый способ так же, как и предыдущий не исключает возникновения охрупчивания.
Термодиффузионный способ оцинкования
Покрытие, полученное с помощью данного метода, является положительным электродом, в то время как сталь отрицательным. Таким образом происходит электрохимическая защита. Термодиффузионное оцинкование может использоваться только для изделий, материалы которых углеродистая сталь, чугун и сталь с небольшим содержанием примесей. Процесс оцинкования происходит следующим образом. Поверхность изделия насыщается цинком, при этом среда должна быть порошковой, а температура 290–450 °C. Марка стали и тип изделия влияют на выбор температуры. Таким способом можно добиться любой толщины защитного слоя от 6 до 110 мкм. При данном методе в закрытый контейнер помещают деталь и добавляют специальную насыщенную смесь. Окончательная обработка требуется для того, чтобы не образовывались белые продукты коррозии на изделиях во время их контакта с соленой водой и конденсатом.
Описанная технология применима для заготовок, имеющих резьбу и сложную геометрическую форму. В результате образуется равномерный слой по всей поверхности, цинк не скапливается в углублениях или соединениях. Благодаря указанному преимуществу не понадобится устранять покрытие на внутренней резьбовой части, как это приходится делать после горячего оцинкования. Также отсутствует охрупчивание, т. е. такая технология подходит для высокопрочного крепежа. Уровень антикоррозийной стойкости в 1,5–2 раза выше, чем при гальваническом оцинковании, и в 3–5 раз выше, чем при горячем способе. Также для указанной технологии характерны большая сцепляемость цинкового слоя с красками, высокая точность, поэтому область применения распространяется и на конструкции, имеющие точные допуски. Нанесенный антикоррозийный слой очень износостойкий, поэтому подходит для деталей, которые часто собираются и разбираются.
Кристаллическая решётка цинка:
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Гексагональная плотноупакованная |
| 513 | Параметры решётки | a = 2,6648 Å, c = 4,9468 Å |
| 514 | Отношение c/a | 1,856 |
| 515 | Температура Дебая | 234 K |
| 516 | Название пространственной группы симметрии | P63/mmc |
| 517 | Номер пространственной группы симметрии | 194 |
Окислительные реакции металла
Окисление цинка происходит на воздухе с образованием оксидной пленки, которая защищает поверхность от дальнейшего разрушения под влиянием реагентов и препятствует вытеснению водорода из воды.
Степенью окисления, которую проявляет химический элемент в соединениях, является +2.
- Цинк легко растворяется в разбавленных соляной и серной кислотах. В результате реакции происходит восстановление серной кислоты до серы или сероводорода.
- В результате реакции цинка с азотной кислотой образуются различные продукты восстановления кислоты.
- При взаимодействии цинка с раствором перманганата калия происходит обесцвечивание раствора.
- Реакция металла с ванадатом калия характеризуется восстановлением ванадия с последовательным изменением цвета раствора: желтый, синий, зеленый, фиолетовый.
- Металлический цинк растворяется в растворах щелочей с высокой концентрацией.
- Оксиды металла можно получить в результате термического разложения карбонатов и синтеза простых веществ.
- Соли цинка легко подвергаются гидролизу. В результате реакции металлического цинка с раствором хлорида металла, выделяется водород.
Где и как добывают Цинк
Цинк является четвертым металлом по применяемости, после железа, алюминия и меди. Ежегодная добыча цинка составляет около 13 миллионов тонн. Крупнейшей в мире кампанией по производству цинка является Nyrstar. Она представляет собой объединение австралийской компании OZ Minerals и бельгийской Umicore. Около 70% цинка получается в результате добычи цинковой руды, а оставшиеся 30% получают в результате переработки вторичного сырья. Коммерческий (чистый) цинк известен как Special High Grade, часто сокращенно SHG
, и имеет чистоту 99,995%
95% цинка, полученного в результате добычи, добываются в сульфидных месторождениях. Основным минералом для производства чистого цинка является сфалерит. Он почти всегда находится в соединении с сульфидом меди, железа и свинца. Рудники добычи цинка разбросаны по всему миру. Лидерами в цинкодобывающей отрасли являются Китай, Австралия и Перу. В 2014 году Китай произвел 38% от общего объема цинка.
Чистый цинк прлизводится в несколько этапов. Добытая руда мелко измельчается. После этого порошок подвергается пенной флотации, для того чтобы получить сульфид цинка. Полученная смесь обычно имеет концентрацию в 50% цинка, 32% серы, 13% железа и 5% оксида кремния. Затем из сульфида цинка получают оксид цинка методом обжига. После этого получение чистого химического элемента может быть достигнуто двумя способами. Первый способ является пирометаллкргическим, а второй заключается в методе электролиза. Пирометаллургический метод предусматривает восстановление оксида цинка с углеродом или монооксидом углерода при температуре около 970°C. При применении метода электролиза для начала раствор выщелачивают серной кислотой, а затем пропускают электрический ток. На выходе получается цинк чистотой 99,995%.
Читайте: Кобальт как химический элемент таблицы Менделеева
Изготовление и применение чистого металла
Многие виды повседневных хозяйственных вещей оцинкованы. Например:
- металлические крыши сооружений,
- водосточные желоба зданий,
- резервуары для воды и т.д.
Достаточно большая доля цинка используется в конструкциях одноразовых цинк-углеродистых не перезаряжаемых аккумуляторов. Процесс изготовления латуни также требует значительных объёмов этого вещества.
Характерной особенностью цинка является образование целого ряда полезных соединений:
- Сульфид (люминофор экранов старых телевизоров, осциллографов, люминесцентные лампы и светящиеся краски);
- Сульфат (защитные средства от сорняков, применение в текстильном производстве);
- Оксид (используется для изготовления резины, способствует улучшению свойств пластмасс, красок, чернила, бетона, косметики).
Многие известные сплавы формируются на цинковой составляющей. Например, латунь, зубная амальгама, бронза и некоторые виды припоев. Оцинковка не только предотвращает ржавление резервуаров для воды. Практически все виды лекарств от кашля и простуды, витаминные таблетки и добавки никак не обходятся без этого вещества.
Часто встречающиеся таблетки (капсулы) биологических добавок включают добавки кальция для укрепления зубов и костей, витамин «С», омега-3 для глаз, а также цинк для усиления иммунитета
Дефицит цинка в организме сопровождается различными проблемами по отношению к здоровью организма, приводит к развитию болезней. Правда, в основном эта проблема характерна для развивающихся стран, где отмечаются факторы недоедания населения, недостаток сбалансированного полезного питания.
Способы оцинкования
Металлургические заводы отличительны не только своим оборудованием, но и применяемыми методами производства. Это зависит от ценовой политики, и месторасположения (природных ресурсов, используемых для металлургической промышленности). Есть несколько методов оцинкования, которые рассматриваются ниже.
Горячий способ оцинкования
Данный способ заключается в обмакивании металлической детали в жидком растворе. Происходит это так:
- Деталь или изделие обезжиривается, очищается, промывается и сушится.
- Далее, цинк расплавляется до жидкого состояния при температуре до 480 °С.
- В жидкий раствор опускается подготовленное изделие. При этом оно хорошо смачивается в растворе и образуется покрытие толщиной до 450 мкм. Это является 100% защитой от воздействия внешних факторов на изделие (влага, прямые солнечные лучи, вода с химическими примесями).
Горячее цинкование металлоконструкций
Но, данный метод имеет ряд недостатков:
- Цинковая пленка на изделии получается неравномерного слоя.
- Нельзя использовать данный метод для деталей, отвечающих точным стандартам по ГОСТу. Где каждый миллиметр считается браком.
- После горячего оцинкования, не каждая деталь останется прочной и износостойкой, поскольку после прохождения высокой температуры появляется хрупкость.
А также данный метод не подходит для изделий, покрытых лакокрасочными материалами.
Холодное оцинкование
Этот метод носит 2 названия: гальванический и электролитический. Методика покрытия изделия защитой от коррозии такова:
- Металлическая деталь, изделие подготавливается (обезжиривается, очищается).
- После этого проводится «метод окрашивания» — применяется специальный состав, имеющий главный компонент – цинк.
- Деталь покрывается данным составом методом распыления.
Холодное цинкование
Благодаря этому методу защитой покрываются детали с точным допуском, изделия, покрытые лакокрасочными материалами. Повышается стойкость к внешним факторам, приводящим к коррозии.
Недостатки данного метода: тонкий защитный слой – до 35 мкм. Это приводит к меньшей защите и небольшим срокам защиты.
Термодиффузионный способ
Данный метод делает покрытие, которое является электродом с положительной полярностью, в то время как металл изделия (сталь) становится отрицательной полярности. Появляется электрохимический защитный слой.
Метод применим только в случае, если детали произведены из углеродистой стали, чугуна, стали с примесями. Цинк используется таким образом:
- При температуре от 290 °С до 450 °С в порошковой среде, поверхность детали насыщается Zn. Здесь маркировка стали, а также тип изделия имеют значение – выбирается соответствующая температура.
- Толщина защитного слоя достигает 110 мкм.
- В закрытый резервуар помещается изделие из стали, чугуна.
- Добавляется туда специальная смесь.
- Последним шагом является специальная обработка изделия от появления белых высолов от солёной воды.
Термодиффузионное цинкование
В основном данным методом пользуются в случае, если требуется покрыть детали, имеющие сложную форму: резьбу, мелкие штрихи. Образование равномерного защитного слоя является важным, поскольку данные детали претерпевают множественное воздействие внешней агрессивной среды (постоянная влага).
Данный метод дает самый большой процент защиты изделия от коррозии
Оцинкованное напыление является износостойким и практически нестираемым, что очень важно для деталей, которые время о времени крутятся и разбираются
Реакции с элементами
Важной целью цинковых взаимодействий с неметаллами является получение бинарных неорганических соединений. Нагретая смесь цинка и серы дает в результате сульфид (ZnS)
Это соединение внешне выглядит как бесцветные кристаллы. Сульфид применяют в лазерной промышленности в качестве полупроводникового материала. Прохождение паров фосфора через цинковые пластины образует ядовитое для живых организмов вещество — фосфид цинка Zn3P2. Фосфид хорошо вступает в реакцию с кислотами. В связи с этим его применяют в борьбе против хозяйственных вредителей, отравляя кислотную среду в желудке грызунов.
При нагревании вплоть до 600 °С реакцию цинка в токе аммиака производит нитрид Zn3N2. Данное соединение является тугоплавким и часто используется в огнеупорных материалах на воздухе. Однако крайне неустойчиво к воде, которая его быстро разлагает. Существует ряд элементов, в реакцию с которыми цинк вступает только в присутствии паров воды: бром, фтор, хлор. Не взаимодействует в принципе с водородом, азотом, углеродом, кремнием и бором.
Взаимодействие с кислотами
Хорошая реакция цинка с большинством кислот обусловлена его положением по отношению к водороду в электрохимическом ряду активности металлов. Так образуется множество важных цинковых солей. Эти соли преимущественно бесцветные, представляют гигроскопичные кристаллы, растворы которых вследствие гидролиза имеют кислотную среду. В случае с солями других металлов он будет также вытеснять их из раствора, если они стоят в ряду напряжения правее от элемента.
При взаимодействии с кислотами образуются соли цинка.
В растворе элемента с серной кислотой при температуре ниже 38 °C образуется цинковый купорос, научное название которого сульфат ZnSO4. Его используют в производстве вискозы, некоторых отраслях металлургии, в медицине как обеззараживающее средство. Хлорид ZnCl2 получают из раствора соляной кислоты с цинком. Его используют в производстве батареек, антисептической пропитке дерева и бумажной фибры.
Производные соединения
- Цинк и его амфотерные свойства передаются гидроксидам цинка Zn (OH)2. Этим веществам присуще химическое поведение кислот и оснований одновременно. Получить гидроксид в виде белого осадка можно действием щелочи на сульфат. В естественном состоянии гидроксид — это кристалловидное вещество, разлагающееся при температуре свыше 130 °C. Применяется для синтеза солей цинка.
- Эффектным можно назвать старый способ добычи оксида ZnO, именуемый ранее как «французский процесс». В присутствии сильно нагретого воздуха вокруг пластины элемента начнут выделяться пары цинка, которые затем воспламеняются голубоватым светом, образуя оксид. На крупном производстве его добывают из природного минерала цинкита. Кроме того, для производства оксида широко применяют термическое разложение более сложных соединений, как, например, гидроксида.
- Бесцветный белый порошок оксида, не растворяющийся в воде, выражает свою химическую двойственность. При сплавлении оксида цинка со щелочами получают цинкаты. При сплавлении с оксидами — силикаты. Собственная теплопроводность позволяет ему быть полупроводником, ширина запрещенной зоны которого равна 3,36 эВ. Оксид имеет широкий спектр применения в химической промышленности, став наполнителем многих пластмасс. В электронике без него не обходится ни одна лучевая трубка телевизора. Он также входит в состав большинства дерматологических мазей.
Ртуть Hg
Ртуть — единственный металл, находящийся при обычной температуре в жидком состоянии (температуре плавления — 38,8°). Ртуть белого цвета. Она обладает меньшей восстановительной активностью, чем цинк. В ряду напряжений ртуть располагается правее водорода, т. е. не вытесняет его из воды и кислот. Радиус атома ртути почти равен радиусу атома кадмия, а заряд ядра атома значительно больше, поэтому электроны внешнего слоя удерживаются ртутью значительно прочнее. ■ 30. Изобразите электронную конфигурацию внешнего и предв-нешнего слоя атома ртути. Объясните, почему среди металлов группы цинка ртуть проявляет наименьшую восстановительную активность. (См. Ответ) Ртуть легко образует с другими металлами сплавы, которые называются амальгамами. Ртуть химически малоактивна и на воздухе без изменений может храниться довольно долго. Однако при длительном слабом нагревании может окисляться, образуя окись ртути: 2Hg + O2 = 2HgO При растирании в ступке ртуть очень легко взаимодействует с серой, образуя сульфид ртути (II) черного цвета: Hg + S = HgS С водой ртуть в реакцию не вступает, но хорошо реагирует с азотной и концентрированной серной кислотами, обладающими сильным окисляющим действием. При этом в зависимости от того, при какой температуре ведется реакция, образуются соли как одновалентной, так и двухвалентной ртути. Ртуть в соединениях может быть одновалентной и двухвалентной. Соединения как одновалентной, так и двухвалентной ртути достаточно устойчивы, хотя и могут превращаться друг в друга. Следует отметить сильную ядовитость ртути, которая даже при комнатной температуре легко испаряется и может вызвать тяжелые отравления, оказывающие сильное влияние на сердце. При попадании соединений ртути внутрь возникает расстройство деятельности органов пищеварения и почек. Очень ядовиты и соединения ртути, такие, как, например, сулема. В промышленности применяется как металлическая ртуть, так и некоторые ее соли. Металлическую ртуть используют при изготовлении термометров, барометров и некоторых измерительных приборов, а также при добыче золота для его очистки от примесей, так как ртуть легко образует амальгамы с золотом и некоторыми другими драгоценными металлами. Этим ее свойством пользуются и в зубоврачебной практике для изготовления пломб.
Соли ртути также находят некоторое применение. Например, сулема HgCl2 используется как дезинфицирующее средство, каломель Hg2Cl2(Cl — Hg — Hg — Cl) — как легкое слабительное. В природе ртуть встречается изредка в самородном жидком состоянии, но чаще в виде соединений, например киновари HgS. Для получения из нее ртути киноварь сначала обжигают: 2HgS + 3O2 = 2HgO + 2SO2 а затем полученную окись ртути HgO разлагают нагреванием: 2HgO = 2Hg + O2 Обычно обе реакции протекают одновременно в едином процессе. ■ 31. Что такое амальгамы? С какой амальгамой вы уже знакомы? (См. Ответ) 32. Перечислите особенности химических свойств ртути. 33. Каково физиологическое действие ртути? 34. Укажите, где применяется металлическая ртуть. 35. Что вам известно о соединениях ртути? 36. В каком виде ртуть может встречаться в природе и как можно получить ее из природных соединений? Подтвердите свой ответ уравнениями реакций. 37. Основываясь на положении ртути в ряду напряжений металлов, опишите отношение ртути к воде, соляной кислоте, разбавленной и концентрированной серной кислоте, разбавленной и концентрированной азотной кислоте. (См. Ответ)
Соли цинка
Практически все соли, которые не являются двойными и комплексными, то есть не содержат посторонних окрашенных ионов, – это бесцветные кристаллические вещества. Самыми популярными в плане использования человеком являются следующие из них.
- Хлорид цинка – ZnCL2. Другое название соединения – паяльная кислота. Внешне представляет собой белые кристаллики, хорошо впитывающие влагу воздуха. Используется для очищения поверхности металлов перед пайкой, получения фибры, в батарейках, для пропитки дерева перед обработкой в качестве дезинфектора.
- Сульфид цинка. Белый порошок, быстро желтеющий при нагревании. Имеет высокую температуру плавления, в отличие от чистого металла. Используется при производстве люминесцирующих составов, наносимых на экраны, панели и прочие предметы. Является полупроводником.
- Фосфид цинка – распространенная отрава, применяемая для избавления от грызущих животных (мышей, крыс).
- Смитсонит, или карбонат цинка – ZnCO3. Бесцветное кристаллическое соединение, нерастворимое в воде. Применяется в нефтехимическом производстве, а также в реакциях получения шелка. Является катализатором в органических синтезах, используется в качестве удобрения для почв.
- Ацетат цинка – (CH3COO)2Zn. Бесцветные кристаллы, хорошо растворимые во всех растворителях любой природы. Находит широкое применение как в химической, так и в медицинской и пищевой промышленности. Используется для лечения нозафарингита. Применяется в качестве пищевой добавки Е650 – освежает дыхание, предупреждает появление налета на зубах, когда входит в состав жвачки. Его же используют для протравливания красителей, консервации древесины, производства пластмасс и прочих органических синтезах. Практически везде играет роль ингибитора.
- Йодид цинка – белые кристаллы, используемые в рентгенографии, в качестве электролита в аккумуляторах, как краситель для электронных микроисследований.
- Черные или темно-зеленые кристаллы, которые невозможно получить прямым синтезом, так как цинк с азотом не реагирует. Образуются из аммиаката металла. При высоких температурах разлагается с высвобождением цинка, поэтому применяется для его получения.
- Нитрат цинка. Бесцветные гигроскопичные кристаллы. Применение цинка в таком виде осуществляется в текстильной и кожевенной промышленностях для протравки тканей.
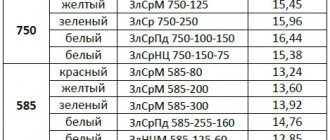
Сплавы цинка
Сплавы на цинковой основе с добавлением меди, магния и алюминия имеют низкую температуру плавления и обладают хорошей текучестью. Они легко поддаются обработке, свариванию и паянию.
Латунь
Различают латуни двухкомпонентные и многокомпонентные.
Двухкомпонентная латунь — сплав цинка с высоким содержанием меди. Существует желтая латунь с медью в количестве 67%, золотистая медь или томпак — 75%, и зеленая — 60%. Такие сплавы могут деформироваться при температуре 300 °C.
Многокомпонентные латуни, помимо 2-х основных металлов, состоят из других добавок: никеля, железа, свинца или марганца. Каждый из элементов влияет на свойства сплава.
ЦАМ — семейство цинковых сплавов. В их состав входят магний, алюминий и медь. Такие сплавы цинка используются в литейном производстве. В них содержится алюминий в количестве 4%.
Основная область применения сплавов ЦАМ — литье цинка под давлением. Сплавы этого семейства обладают низкой температурой плавления и хорошими литейными свойствами. Их высокопрочность позволяет производить прочные и сложные детали.
Вирениум
Сплав состоит из цинка (24,5%), меди (70%), никеля (5,5%).
Наибольшее количество цинка содержится в устрицах, мясе, печени (других субпродуктах), рыбе, яйцах, твердых сырах, какао, крупах, орехах.
К признакам нехватки цинка относятся:
- потеря обоняния, вкуса и аппетита
- ломкость ногтей и появление белых пятнышек на ногтях
- выпадение волос
- частые инфекции
- плохое заживление ран
- позднее половое содержание
- импотенция
- утомляемость, раздражительность
- снижение способности к обучению
- поносы
Цинк активно применяется в современной жизни:
- Цинк часто используется для создания специального покрытия, благодаря которому изделие меньше подвергается ржавчине и разрушению. Такие вещи называют оцинкованными. Этот прием защиты от коррозии активно используется в строительной и автомобильной промышленности.
- Из цинка делают сплавы с другими металлами, что активно применяется в машиностроении.
- Этот металл входит в состав аккумуляторов.
- Цинк добавляют в краски. В продаже имеются цинковые белила, которые используют художники для рисования картин, маляры для покраски помещений. Также эта белая краска используется для смешивания с другими цветами и получения новых оттенков.
- В химической промышленности металл используют, когда необходимо провести реакцию органического синтеза.
- Цинк входит в состав электродов, которые находятся внутри бытовых приборов.
- Металл, измельчённый до порошкообразного состояния (он называется оксидом), используют в фармацевтической промышленности. Он входит в состав мазей, кремов и присыпок, оказывающих противовоспалительное и подсушивающее действие.
- Цинк является наполнителем для резины.
Внимание! В организме цинк играет важную роль, так как поддерживает гомеостаз. Также он отвечает за формирование первичных половых признаков, поддерживает в норме обменные процессы.
Данный металл активно вступает во взаимодействие с кислородом, водой, кислотами и щелочами, водородом, используется в различных сферах человеческой жизни.