Что такое сплав
Давайте рассмотрим этот вопрос подробнее. Итак, сплав – это соединение нескольких металлов или одного и различных неметаллических добавок. Такие соединения используются повсеместно. Сплав – это макроскопическая однородная система, полученная методом плавления. Они были известны еще с самых древних времен, когда человечество при помощи примитивных технологий научилось производить чугун, бронзу, а немного позже – сталь.
Производство и использование этих материалов обусловлено тем, что можно получить сплав с заданными технологическими свойствами, при этом многие характеристики (прочность, твердость, коррозионная стойкость и другие) выше, чем у отдельных его компонентов.
Интерметаллические сплавы
Состав интерметаллических соединений обычно выражается формулами, совершенно несовместимыми с теми валентностями, которые металлы проявляют в соединениях с металлоидами. Так, например, натрий образует с оловом и свинцом следующие ряды соединений:
NaSn6NaSn4, NaSn3, NaSn2, NaSn, Na4Sn2, Na2Sn, Na3Sn, Na4Sn, NaPb, Na2Pb, Na4Pb
Многие интерметаллические соединения очень прочны и не разлагаются при температурах, лежащих значительно выше их точек плавления.
Интерметаллические соединения обладают способностью растворяться в жидком аммиаке, образуя проводящие ток растворы. При электролизе таких растворов один из металлов, менее электроположительный, выделяется на аноде, другой— на катоде. Например, при электролизе раствора Na4Pb9на аноде выделяется свинец, а на катоде — натрий.
В растворах интерметаллические соединения могут вступать в реакции обмена с различными солями. Например:
2Ca(NO3)2+ K4Pb =Ca2Pb + 4KNO3
Металлы могут вытесняться из интерметаллических соединений другими металлами совершенно так же, как из обыкновенных солей.
Образование интерметаллических соединений теоретически пока еще не объяснено. Установлено лишь, что очень близкие по химическим свойствам металлы обычно не образуют соединений друг с другом.
В последнее время при изучении сплавов широко применяются методы рентгеновского анализа, позволяющие устанавливать внутреннее строение кристаллов, образующих сплав, и определять их кристаллические решетки.
Свойства сплавов во многом отличаются от свойств сплавляемых металлов, отнюдь не являясь их средними арифметическими, ввиду образования при сплавлении различных химических соединений или твердых растворов.
Температура плавления сплавов очень часто бывает ниже температуры плавления наиболее легкоплавкой составной части сплава. Примером сплава с очень низкой температурой плавления может служить сплав, состоящий из свинца (4 ч.), олова (2 ч.), висмута (6 ч.) и кадмия (1 ч.). Он плавится около 75°, т. е. уже при опускании в горячую воду, между тем как температура плавления самого легкоплавкого из четырех названных металлов — олова — равна 231,9°. Наоборот, твердость сплавов обычно больше твердости их составных частей, особенно если при сплавлении образуются химические соединения металлов, которые, как правило, тверже, чем сплавляемые металлы, но зато и более хрупки. Очень большой твердостью обладают сплавы, содержащие твердые растворы.
203 204 205
Вы читаете, статья на тему Сплавы
Основные виды
Как классифицируют сплавы? Это делают по типу металла, который является основой соединения, а именно:
- Черные. Основа – железо. К черным сплавам относятся все виды сталей и чугунов.
- Цветные. Основа – один из цветных металлов. Самые распространенные цветные сплавы – на основе меди и алюминия.
- Сплавы редких металлов. На основе ванадия, ниобия, тантала, вольфрама. Применяются преимущественно в электротехнике.
- Сплавы радиоактивных металлов.
К основному компоненту в сплав добавляют другие элементы – металлы и неметаллы, которые улучшают его технологические свойства. Эти добавки называют легирующими. Также в сплавах присутствуют вредные примеси – при превышении их допустимого значения у материала снижаются многие характеристики. Итак, теперь вы знаете, что такое сплав.
Сплавы также классифицируют на двойные, тройные и другие – по числу компонентов. По однородности структуры – на гомогенные и гетерогенные. По отличительным свойствам – на легкоплавкие и тугоплавкие, высокопрочные, жаростойкие, антифрикционные, коррозионностойкие и материалы со специальными свойствами.
Сплавы. Виды, характеристики сплавов
Из-за низких механических свойств чистые металлы как конструкционные материалы в машиностроении находят ограниченное применение по сравнению со сплавами.
Сплав — это конструкционный материал, полученный путем сплавления нескольких химических элементов (металлов и неметаллов) и обладающий свойствами, присущими основному сплавляемому элементу.
Металлический сплав может быть получен не только сплавлением химических элементов, но и такими способами, как спекание, электролиз, диффузия, плазменное напыление, возгонка и др. Конструкционный материал, полученный не сплавлением, называется псевдосплавом. Если сплав имеет в своем составе 50 % металла и более, то он называется металлическим сплавом.
Металлический сплав имеет более высокие механические и технологические свойства по сравнению с неметаллическим сплавом. Химические элементы, образующие сплав, называются компонентами.
По своему составу сплавы могут быть двухкомпонентными (металл + металл, металл + неметалл), трех- и более компонентными. Внутреннее строение сплавов определяется формой связи между компонентами.
Двухкомпонентные сплавы при нагревании (охлаждении) в силу особенностей взаимодействия друг с другом ведут себя неадекватно и, в связи с этим, имеют различное физическое строение и свойства.
К промышленным сплавам, которые находят широкое применение, относятся:
- чугун и сталь — сплавы железа с углеродом;
- латунь — сплав меди с цинком;
- бронза — сплав меди с оловом и др.
Сплавы имеют атомно-кристаллическое строение, обладают аллотропией (полиморфизмом) и, по сравнению с чистыми металлами, более высокими механическими и технологическими свойствами.
Форма металлической связи сплавляемых химических элементов влияет на образование структуры сплава, их атомно-кристаллическую решетку.
Фазы. Сплавам, так же как и чистым металлам, характерно атомно-кристаллическое строение. Сплав в твердом состоянии может иметь различную связь атомно-кристаллических решеток. Жидкое или твердое состояние химических компонентов, образующих сплав при определенной температуре и давлении, называется системой.
Однородная часть системы, отделенная от других частей условной границей (линией), называется фазой.
Жидкая фаза характеризуется тем, что атомные кристаллические решетки сплавляемых компонентов распадаются и компоненты растворяются друг в друге или не растворяются и присутствуют в сплаве самостоятельно. Эта закономерность присуща многим сплавам.
Твердая фаза — это однородная часть сплава с определенными атомно-кристаллическим строением и массовой долей сплавляемых компонентов. Атомные решетки сплавляемых компонентов взаимодействуют в строго определенном порядке. Атомные решетки химических элементов, образующих сплав в твердом состоянии, образуют мелкие кристаллы — структуры.
В зависимости от внутреннего строения сплавов и металлической или химической связи между сплавляемыми элементами сплавы подразделяются на две группы:
- однородные сплавы;
- неоднородные сплавы.
Однородные сплавы имеют общие атомные кристаллические решетки, в которые входят атомы сплавляемых компонентов.
Неоднородные сплавы имеют самостоятельные кристаллические решетки сплавляемых компонентов.
По характеру взаимодействия сплавляемых компонентов в твердой фазе различают механические смеси, твердые растворы и химические соединения.
Механическая смесь сплавляемых компонентов А и Б (рис. 1, а) образуется тогда, когда атомные кристаллические решетки сохраняются и не вступают в химическую реакцию с образованием какого-либо нового соединения. Связь между атомными решетками осуществляется за счет металлической связи. Механическая смесь сплава будет неоднородного типа, т. е. сплавляемые компоненты А и Б в сплаве будут самостоятельными и чередоваться между собой в зависимости от их соотношения.
Рис. 1. Схематическое изображение структуры сплава: а — механическая смесь; б — твердый раствор (I — раствор замещения; II — раствор внедрения); в — химическое соединение; А, Б — сплавляемые компоненты
Свойства механической смеси зависят от свойств сплавляемых компонентов А и Б. Как правило, эти микроструктуры имеют относительно высокую твердость, прочность, ударную вязкость, хорошо обрабатываются резанием.
Твердые растворы в зависимости от взаимодействия атомов подразделяются на твердые растворы внедрения и твердые растворы замещения (рис. 1, б ).
На рис. 1, б, I показана атомно-кристаллическая решетка твердого раствора замещения. Атомно-кристаллическая решетка основного компонента А в форме объемно-центрированного куба (девять атомов) сохранилась, но три атома этого компонента замещены атомами сплавляемого компонента Б.
На рис. 1, б, II показана атомно-кристаллическая решетка твердого раствора внедрения. При этом виде образования сплава атомно-кристаллическая решетка основного компонента А сохраняется. Атомно-кристаллическая решетка сплавляемого компонента Б разрушается, и его отдельные атомы внедряются в пространство атомно-кристаллической решетки основного компонента А. Таким образом, в атомно-кристаллической решетке твердого раствора внедрения девять атомов, как в основном компоненте А, плюс два-три атома компонента Б.
Твердые растворы по своим свойствам наиболее близки к свойствам основного компонента. Они имеют низкую твердость, высокую плотность, ударную вязкость, прочность, хорошо деформируются в холодном и горячем состоянии. Микроструктура большинства конструкционных и инструментальных сталей представляет собой твердые растворы внедрения и замещения.
Химические соединения сплава образуются тогда, когда атомно-кристаллические решетки сплавляемых компонентов А и Б распадаются. Отдельные атомы этих компонентов образуют новые атомные решетки, которые по своему типу, форме и числу атомов отличаются от атомно-кристаллических решеток сплавляемых компонентов.
Химические соединения в сплаве образуются при строго определенном массовом соотношении сплавляемых компонентов А и Б. Например, химическое соединение углерода с железом образуется при массовой доле углерода, равной 6,67 %.
Свойства химических соединений также резко отличаются от свойств сплавляемых компонентов. Химические соединения, как правило, очень твердые, хрупкие, тугоплавкие, имеют мелкозернистую или игольчатую микроструктуру. На рис. 1, в показана атомно-кристаллическая ячейка химического соединения углерода с железом. Это сложная ромбическая пространственная атомно-кристаллическая решетка, состоящая из атомов железа и атомов углерода (компонентов А и Б).
В практике чаще всего в сплаве наблюдается смесь нескольких соединений (микроструктур), например механическая смесь химического соединения и твердого раствора или механическая смесь двух твердых растворов.
Диаграммы состояния двухкомпонентных сплавов. Любое изменение химического состава сплава влечет за собой изменение физических параметров: температуры, давления и структуры. Изменение этих параметров на границах фаз происходит скачкообразно или замедленно.
В практике металловедения для определения температур, давления, структуры и взаимодействия сплавляемых компонентов применяют графики — диаграммы состояния сплавов. Для этого нагревают (охлаждают) сплав в закрытом тигле с помощью термопары, по прибору наблюдают поведение этого сплава и по наблюдениям строят соответствующие графики.
На диаграммах состояния отображаются только условия, когда сплав имеет постоянные параметры, — равновесие, поэтому в научной литературе диаграммы состояния также называют диаграммами равновесия. В связи с тем что сплавляемые компоненты (металлы и неметаллы) обладают аллотропией, при нагревании (охлаждении) в сплавах происходят аллотропные изменения. Аллотропные изменения можно наблюдать при лабораторных исследованиях с помощью термического метода, а иногда визуально (цвет сплава становится ярче или, наоборот, тускнеет, или длительное время остается постоянным).
Любое изменение в металле при нагревании (охлаждении) характеризуется определенной температурой, которая называется критической температурой. Критические температуры на прямой отражаются соответствующими точками, которые называются критическими точками. Если рассматривать любой металл или сплав в одном измерении (температура нагрева), то графическая характеристика будет отображена в виде вертикальной прямой, на которой указывают критические температуры (точки). Если состояние металла или сплава рассматривать в двух измерениях (температура нагрева (охлаждения) и время нагрева (охлаждения), то график будет изображен в двух координатах (ось ординат и ось абсцисс).
Для примера рассмотрим состояние чистого железа при нагревании и охлаждении. На рис. 2 приведены критические температуры чистого железа при нагревании (охлаждении). Железо имеет следующие критические точки (температуры): 768; 910; 1 392 и 1 539 °С. При температуре 910 °С Fе-α (α-железо) переходит в Fе-β (β-железо). При температуре 1 392 °С Fе-β переходит в Fe-γ (γ-железо). При температуре 1 539 °С Fe-γ начинает медленно расплавляться с поглощением энергии (температуры).
При всех критических температурах на диаграммах показаны задержки перекристаллизации (горизонтальные участки). При охлаждении железа процесс перекристаллизации происходит в обратном порядке.
Для двухкомпонентных сплавов диаграмма состояния — это графическое изображение состояния сплавов в двух измерениях: температура нагрева (охлаждения) и химический состав сплава (концентрация).
Рис. 2. Кривые нагрева и охлаждения железа: t — температура; τ — время
Температуру нагрева (охлаждения) откладывают по оси ординат, по оси абсцисс откладывают массовую долю сплавляемых компонентов (концентрация).
Для примера рассмотрим диаграмму состояния двухкомпонентного сплава свинец — сурьма (рис. 3). На оси абсцисс слева берем 100 % свинца (Pb), справа — 100 % сурьмы (Sb). Свинец и сурьма в жидком состоянии неограниченно растворяются друг в друге, в твердом состоянии — образуют механическую смесь сплавляемых компонентов.
При нагревании (охлаждении) сплава от твердого состояния до температуры плавления (а при охлаждении от жидкого состояния до температуры затвердевания) в сплаве происходит образование механических смесей (эвтектика) и расплавление при различных температурах.
Возьмем чистый свинец. При нормальной температуре и до температуры 245 °С в свинце никаких изменений внутреннего строения не происходит, и свинец будет иметь структуру Рb-α (α-свинец). При температуре 245 °С Рb-α перестраивается в Рb-β (β-свинец). Эта структура остается до температуры 327 °С.
При температуре 327 °С свинец начинает расплавляться. При расплавлении за счет поглощения энергии (температуры) температура свинца остается постоянной — 327 °С. При охлаждении свинца процесс происходит в обратном порядке.
Рис. 3. Кривые охлаждения и структуры (а, б, в, д, е), диаграмма состояния (г) сплавов свинец—сурьма: 1 — температура ликвидуса; 2 — температура солидуса; АВС — линия ликвидуса; DBE — линия солидуса; Ж — жидкость; Эвт. — эвтектика
При нагревании сурьмы до температуры 245 °С никаких изменений в металле не происходит. Структура сурьмы будет Sb-α (α-сурьма). При температуре 245 °С Sb-α переходит в Sb-β. При температуре 631°С сурьма начинает расплавляться. В связи с тем что при расплавлении происходит большое поглощение теплоты, температура расплавления сурьмы на 8 … 10 °С будет ниже. При охлаждении процесс идет в обратном порядке. Далее рассмотрим поведение типовых сплавов свинца и сурьмы: 95 % Рb + 5 % Sb; 87 % Рb + 13 % Sb; 60 % Рb + 40 % Sb. Для составления диаграммы состояния двухкомпонентного сплава свинец — сурьма строим кривые нагрева (охлаждения).
При нагревании (охлаждении) 100 % Pb (рис. 3, а) при температуре 327 °С на графике будет горизонтальный участок. При нагревании (охлаждении) сплава 95 % Рb + 5 % Sb (рис. 3, б) при температуре 245 °С на графике будет горизонтальный участок. Далее при нагревании (охлаждении) при температуре 300 °С будет перегиб кривой, при этой температуре сплав начнет расплавляться (при нагревании) или кристаллизоваться (при охлаждении). При нагревании (охлаждении) сплава 87 % Рb + 13 % Sb (рис. 3, в) при температуре 245 °С также будет горизонтальный участок. При этой температуре сплав начинает плавиться и заканчивает расплавление при температуре 245 °С.
При нагревании (охлаждении) сплава 60 % Рb + 40 % Sb (рис. 3, д) до температуры 245 °С в структуре сплава никаких изменений не происходит. При температуре 245 °С свинец начинает расплавляться — на графике будет горизонтальный участок. При дальнейшем нагревании (охлаждении) при температуре 350 °С сплав расплавляется (при нагревании) или начинает кристаллизоваться (при охлаждении).
При нагревании (охлаждении) 100 % сурьмы (рис. 3, е) до температуры 631 °С сплав будет иметь твердую фазу, и при температуре 631 °С на графике будет горизонтальный участок, сурьма начинает расплавляться. За счет поглощения энергии расплавление сурьмы происходит при температуре несколько ниже 631 °С.
Для наглядного изображения характеристики сплава свинец — сурьма строим следующий график. На оси ординат откладываем температуры нагрева (охлаждения) от нормальной температуры. На этой оси будем откладывать критические точки для 100 % свинца. На оси абсцисс откладываем массовую долю в сплаве свинца и сурьмы. Справа проводим ось температур для 100 % содержания сурьмы. Далее на оси ординат проектируем критические точки, полученные в результате нагрева рассмотренных ранее сплавов.
Как видим из графиков, первое фазовое изменение сплавов происходит при температуре 245 °С. Проводим горизонтальную прямую DE, соответствующую этой температуре. На оси температур свинца проектируем точку, соответствующую температуре 327 °С — температуре плавления чистого свинца. Полученную точку обозначим буквой А.
На оси температур сурьмы проектируем точку, соответствующую 631 °С — температуре плавления сурьмы. Полученную точку обозначим буквой С. На оси абсцисс из точки, соответствующей 87 % Рb и 13 % Sb, восстанавливаем перпендикуляр (пунктиром) до горизонтальной прямой DE (температура расплавления данного сплава). Точку А (критическую температуру 327 °С) на оси ординат соединяем с критической точкой, лежащей на горизонтальной прямой, соответствующей температуре плавления данного сплава (87 % Рb + 13 % Sb). Полученную точку обозначим буквой В.
На оси абсцисс из точки, соответствующей 95 % Рb и 5 % Sb, восстанавливаем перпендикуляр до пересечения с отрезком АВ. В данной точке имеем критическую температуру 300 °С — температуру плавления (затвердевания) сплава 95 % Pb + 5 % Sb.
На оси абсцисс из точки, соответствующей 60 % Рb и 40 % Sb, восстанавливаем перпендикуляр до пересечения с отрезком ВС, получаем точку, которая соответствует критической температуре 350 °С — плавления (затвердевания) сплава 60 % Pb + 40 % Sb.
Таким образом, мы получили диаграмму состояния двухкомпонентного сплава свинец — сурьма. Все сплавы Рb— Sb независимо от массовой доли компонентов до температуры 245 °C имеют твердую фазу — механическая смесь. Сплав по линии DВЕ начинает медленно расплавляться при нагревании и затвердевает при охлаждении. Эту линию называют линией солидуса (от лат. solidus — твердый).
По линии АВС сплавы расплавляются при нагревании, при охлаждении начинают медленно кристаллизоваться. Эта линия называется линией ликвидуса (от лат. liquidus — жидкий). Между линиями DBE и линией АВС сплавы находятся в полужидком состоянии. Сплав с 87 % Рb и 13 % Sb имеет самую низкую температуру плавления (затвердевания). Этот сплав, так же как и чистые металлы, плавится при одной температуре. Такие сплавы получили название эвтектических сплавов.
Эвтектика — мелкодисперсная механическая смесь двух компонентов, образовавшаяся при температуре плавления (кристаллизации), значительно ниже температуры плавления сплавляемых компонентов в процессе затвердевания. Левее эвтектики сплавы называются доэвтектическими, правее — заэвтектическими.
Рассмотрим фазовые состояния сплава свинец — сурьма. Выше линии АВС сплав находится в жидком состоянии (жидкая фаза), между линией АВ и DB — в полужидком (Pb + жидкость). Ниже лини DB сплав состоит из механической смеси свинца и эвтектики. Между линиями ВС и ВЕ сплав будет иметь полужидкую фазу и кристаллы сурьмы. Ниже линии ВЕ сплав будет состоять из механической смеси (эвтектика и сурьма).
Диаграмма состояния сплава Pb — Sb относится к типу диаграмм, в которых сплавляемые компоненты неограниченно растворяются в жидком состоянии и не растворяются в твердом состоянии, образуя механические смеси (эвтектика).
Анализируя диаграмму состояния сплавов, можно изучить следующие характеристики: температуру плавления (кристаллизации), виды структур сплавов, способность образовывать ликвацию, режимы термообработки и обработки давлением. При изучении диаграмм состояния двухкомпонентных сплавов следует обращать внимание на превращение компонентов сплавов в кристаллическом (твердом) состоянии.
В связи с этим различают следующие особенности аллотропных изменений сплавов (типовые диаграммы состояния):
- диаграммы состояния первого рода — для сплавов, компоненты которых полностью растворяются в жидком состоянии, ограниченно растворяются в твердом состоянии и образуют механические смеси (Pb— Sb, Sn— Zn и др.);
- диаграммы состояния второго рода — для сплавов, компоненты которых полностью растворяются в жидком и твердом состоянии с образованием твердых растворов (Ag— Au, Cu— Ni; Fe— V и др.);
- диаграммы состояния третьего рода — для сплавов, компоненты которых неограниченно растворяются в жидком состоянии, практически не растворяются в твердом состоянии и образуют механические смеси (эвтектика) с полиморфным превращением (первичным и вторичным) структурно-фазового состава;
- диаграммы состояния четвертого рода — для сплавов, компоненты которых в жидком состоянии растворяются друг в друге, а в твердом состоянии образуют устойчивые или неустойчивые химические соединения.
728
Механические свойства
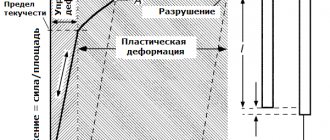
Механические свойства сплавов определяют работоспособность материала при воздействии на него внешних сил. Для того чтобы выяснить характеристики соединения, образец подвергают различным испытаниям (растягивают, царапают, нагружают, вдавливают в него металлический шарик или алмазный конус, изучают под микроскопом) на определение прочности, упругости, пластичности.
Сплав как технологический процесс
Данный процесс является неотъемлемой частью лесозаготовительных работ и представляет из себя вид транспортировки леса (бревен) по воде. В зависимости от водного пути, по которому направляются лесозаготовки, а также от времени года, сплав бывает:
- молевой;
- плотовой;
- кошельный.
Первый вид сплава применялся раньше во времена весеннего паводка на труднодоступных участках рек и представлял из себя простое сплавление бревен, не связанных меж собою. Данный вид запрещен в РФ с 1995 г., т. к. сплавляемые бревна движутся по реке хаотично, что может привести к затору русла рек. Второй способ сплава осуществляется в период, когда реки несудоходны или малосудоходны. При этом варианте бревна увязывают в плот (или в пучок) и их обязательно сопровождают маломерные суда (катера или малые моторные лодки). Третий вид сплава применяется только во время, когда реки полностью судоходны. Суть его заключается в том, что бревна подрезают до одинакового размера, формируют из них отдельные партии, огражденные плавучими стенками.
Каждая такая огороженная партия называется «кошелем» и его сплав всегда контролируется среднеразмерным речным флотом.
Химические
Что такое химические свойства сплава? Это характеристики, определяющие, как материал реагирует на воздействие различных активных, в том числе и агрессивных средств. Химическое воздействие среды можно увидеть визуально: железо «съедает» ржавчина, на бронзе появляется зеленый налет оксидов, сталь растворяется в серной кислоте.
В металлургии и тяжелом машиностроении применяется множество способов борьбы с агрессивным влиянием внешней среды: разрабатываются новые, более стойкие материалы на основе меди, титана и никеля, сплавы покрывают защитными слоями – лаками, красками, окисными пленками, улучшают их структуру. В результате негативных факторов среды промышленность ежегодно терпит ущерб, исчисляемый миллионами тонн стали и чугуна.
История
Одно из наиболее известных мест, где были найдены бронзовые изделия, располагалось в районе реки Кубань. В этом месте археологом Николаем Веселовским в 1897 году была раскопана так называемая Майкопская культура, существовавшая во второй половине IV тысячелетия до нашей эры.
Бронзовые артефакты, найденные в майкопских курганах, были изготовлены в основном из сплава меди и мышьяка, поэтому считается, что исторически первыми были именно такие сплавы, называемые мышьяковистыми бронзами.
Она ничем не уступала по своим свойствам сплавам меди с оловом или свинцом, и даже превосходила их по ряду характеристик. Она широко применялась в различных областях человеческой деятельности тех времён, начиная от изготовления ответственных деталей и заканчивая ювелирными изделиями.
Состав бронзы
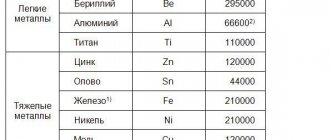
Бронза — это сплав меди с такими металлами, как олово, алюминий, свинец, бериллий, и неметаллами — мышьяк, кремний и фосфор. Кроме того, такие сплавы могут дополнительно легироваться фосфором, цинком, марганцем, железом и никелем.
Состав бронзы зависит от марки сплава и указывается в её обозначении. Например, в состав сплава, имеющего маркировку БрАМц7−1, входят 7% алюминия, 1% марганца и 92% меди.
Таким образом, основным компонентом этого металла является медь (от 35% до 90% и выше). Вторым же компонентом может являться либо мышьяк, либо олово или бериллий, свинец, алюминий, кремний и другие компоненты. Для придания особых свойств в сплав могут добавляться дополнительные компоненты — цинк, железо, никель, марганец, фосфор и другие.
Технологические
Технологичность – это что такое? Сплав в промышленности нужен не сам по себе, из него изготавливают какую-либо деталь. Следовательно, материал будут нагревать, резать, деформировать, подвергать термической обработке и проводить другие манипуляции. Технологичность – это способность сплава подвергаться разным способам горячей и холодной обработки, например плавиться, легко растекаться и заполнять литейную форму, деформироваться в горячем или холодном виде (ковка, горячая и холодная штамповка), свариваться, обрабатываться металлорежущим инструментом.
Технологические свойства можно разделить на:
- Литейные. Они характеризуются жидкотекучестью – способностью заполнять форму для литья, усадкой (процент потери объема после охлаждения, отвердевания) и ликвацией – сложным процессом, при котором образуется неоднородная структура материала в разных частях отливки.
- Ковкость. Это способность сплава деформироваться под ударной нагрузкой и принимать нужную форму без потери целостности. Некоторые металлы обладают хорошей ковкостью только в горячем виде, другие – в холодном и в горячем состоянии. Например, сталь куют в раскаленном виде. Сплавы алюминия и латунь хорошо принимают нужную форму при комнатной температуре. Бронза плохо поддается ударной деформации, а чугуны не пластичны и под воздействием молота разрушаются (за исключением ковкого чугуна).
- Свариваемость. Хорошей свариваемостью обладает низкоуглеродистая сталь, гораздо хуже эта характеристика у высоколегированных сталей и чугунов.
Отрывок, характеризующий Сплав
– Имею честь доложить, господин полковник, зарядов имеется только восемь, прикажете ли продолжать огонь? – спросил он. – Картечь! – не отвечая, крикнул старший офицер, смотревший через вал. Вдруг что то случилось; офицерик ахнул и, свернувшись, сел на землю, как на лету подстреленная птица. Все сделалось странно, неясно и пасмурно в глазах Пьера. Одно за другим свистели ядра и бились в бруствер, в солдат, в пушки. Пьер, прежде не слыхавший этих звуков, теперь только слышал одни эти звуки. Сбоку батареи, справа, с криком «ура» бежали солдаты не вперед, а назад, как показалось Пьеру. Ядро ударило в самый край вала, перед которым стоял Пьер, ссыпало землю, и в глазах его мелькнул черный мячик, и в то же мгновенье шлепнуло во что то. Ополченцы, вошедшие было на батарею, побежали назад. – Все картечью! – кричал офицер. Унтер офицер подбежал к старшему офицеру и испуганным шепотом (как за обедом докладывает дворецкий хозяину, что нет больше требуемого вина) сказал, что зарядов больше не было. – Разбойники, что делают! – закричал офицер, оборачиваясь к Пьеру. Лицо старшего офицера было красно и потно, нахмуренные глаза блестели. – Беги к резервам, приводи ящики! – крикнул он, сердито обходя взглядом Пьера и обращаясь к своему солдату. – Я пойду, – сказал Пьер. Офицер, не отвечая ему, большими шагами пошел в другую сторону. – Не стрелять… Выжидай! – кричал он. Солдат, которому приказано было идти за зарядами, столкнулся с Пьером. – Эх, барин, не место тебе тут, – сказал он и побежал вниз. Пьер побежал за солдатом, обходя то место, на котором сидел молоденький офицерик. Одно, другое, третье ядро пролетало над ним, ударялось впереди, с боков, сзади. Пьер сбежал вниз. «Куда я?» – вдруг вспомнил он, уже подбегая к зеленым ящикам. Он остановился в нерешительности, идти ему назад или вперед. Вдруг страшный толчок откинул его назад, на землю. В то же мгновенье блеск большого огня осветил его, и в то же мгновенье раздался оглушающий, зазвеневший в ушах гром, треск и свист. Пьер, очнувшись, сидел на заду, опираясь руками о землю; ящика, около которого он был, не было; только валялись зеленые обожженные доски и тряпки на выжженной траве, и лошадь, трепля обломками оглобель, проскакала от него, а другая, так же как и сам Пьер, лежала на земле и пронзительно, протяжно визжала. Пьер, не помня себя от страха, вскочил и побежал назад на батарею, как на единственное убежище от всех ужасов, окружавших его. В то время как Пьер входил в окоп, он заметил, что на батарее выстрелов не слышно было, но какие то люди что то делали там. Пьер не успел понять того, какие это были люди. Он увидел старшего полковника, задом к нему лежащего на валу, как будто рассматривающего что то внизу, и видел одного, замеченного им, солдата, который, прорываясь вперед от людей, державших его за руку, кричал: «Братцы!» – и видел еще что то странное. Но он не успел еще сообразить того, что полковник был убит, что кричавший «братцы!» был пленный, что в глазах его был заколон штыком в спину другой солдат. Едва он вбежал в окоп, как худощавый, желтый, с потным лицом человек в синем мундире, со шпагой в руке, набежал на него, крича что то. Пьер, инстинктивно обороняясь от толчка, так как они, не видав, разбежались друг против друга, выставил руки и схватил этого человека (это был французский офицер) одной рукой за плечо, другой за гордо. Офицер, выпустив шпагу, схватил Пьера за шиворот. Несколько секунд они оба испуганными глазами смотрели на чуждые друг другу лица, и оба были в недоумении о том, что они сделали и что им делать. «Я ли взят в плен или он взят в плен мною? – думал каждый из них. Но, очевидно, французский офицер более склонялся к мысли, что в плен взят он, потому что сильная рука Пьера, движимая невольным страхом, все крепче и крепче сжимала его горло. Француз что то хотел сказать, как вдруг над самой головой их низко и страшно просвистело ядро, и Пьеру показалось, что голова французского офицера оторвана: так быстро он согнул ее. Пьер тоже нагнул голову и отпустил руки. Не думая более о том, кто кого взял в плен, француз побежал назад на батарею, а Пьер под гору, спотыкаясь на убитых и раненых, которые, казалось ему, ловят его за ноги. Но не успел он сойти вниз, как навстречу ему показались плотные толпы бегущих русских солдат, которые, падая, спотыкаясь и крича, весело и бурно бежали на батарею. (Это была та атака, которую себе приписывал Ермолов, говоря, что только его храбрости и счастью возможно было сделать этот подвиг, и та атака, в которой он будто бы кидал на курган Георгиевские кресты, бывшие у него в кармане.) Французы, занявшие батарею, побежали. Наши войска с криками «ура» так далеко за батарею прогнали французов, что трудно было остановить их.
Сплавы, их классификация и свойства
Существует несколько способов классификации сплавов:
- по способу изготовления (литые и порошковые сплавы);
- по способу получения изделия (литейные, деформируемые и порошковые сплавы);
- по составу (гомогенные и гетерогенные сплавы);
- по характеру металла – основы (черные –основа Fe, цветные – основа цветные металлы и сплавы редких металлов – основа радиоактивные элементы);
- по числу компонентов (двойные, тройные и т.д.);
- по характерным свойствам (тугоплавкие, легкоплавкие, высокопрочные, жаропрочные, твердые, антифрикционные, коррозионностойкие и др.);
- по назначению (конструкционные, инструментальные и специальные).
На что обратить внимание во время сплава
1. На реке всегда носи спасательный жилет и убедись, что он плотно прилегает к телу. Даже если ты хороший пловец, пренебрегать этой мерой безопасности нельзя.
2. Помни, что шлемы в основном предназначены для того, чтобы уберечь тебя от весел восторженных товарищей по рафтингу и очень редко — в качестве защиты от камней на реке. Однако, поскольку такая опасность есть, не снимай шлем до окончания сплава и убедись, что он надежно закреплен на твоей голове.
3. Не привязывай / не обматывай веревкой запястья, руки, ноги или шею! Это может быть опасно, если ты упадешь в воду.
4. Не ставь ноги на страховочный трос снаружи рафта во время гребли. Так ты можешь пострадать, если ударишься о валун.
5. В случае, если рафт вот-вот ударится о валун, не пытайся остановить двухтонный импульс надувного судна своим легким веслом, ногой или руками, поскольку так можно получить травму.
6. Прекрати водные бои и другие забавные занятия перед порогами и убедись, что личное защитное снаряжение — спасательный жилет и шлем — плотно прилегают к телу.
7. Если ты упал в воду, не паникуй и расслабься: спасательный жилет немедленно поднимет тебя на поверхность. Существует около 90% вероятности, что ты всплывешь прямо рядом с рафтом. Хватайся за него. Помни, что надувное судно — это твой самый большой спасательный жилет на реке.
В случае, если ты окажешься вдали от рафта, ляг на спину, направив ноги вниз по течению. Не пытайся резко встать, так как можешь зацепиться ногой за камень или другое подводное препятствие. Внимательно слушай своего гида, даже если его указания противоречат твоим инстинктам — плыви туда и так, как он скажет.
8. Получай удовольствие! Если ты сплавляешься вместе с опытным гидом и четко следуешь его инструкциями, не забывая о мерах безопасности, то рафтинг принесет массу ярких впечатлений, и ты наверняка захочешь повторить!
Задачи для самостоятельного решения.
Несложные задачи с двумя компонентами смеси.
1-1.
Смесь меди и алюминия массой 20 г обработали 96 %-ным раствором азотной кислоты, при этом выделилось 8,96 л газа (н. у.). Определить массовую долю алюминия в смеси.
1-2.
Смесь меди и цинка массой 10 г обработали концентрированным раствором щелочи. При этом выделилось 2,24 л газа (н.y.). Вычислите массовую долю цинка в исходной смеси.
1-3.
Смесь магния и оксида магния массой 6,4 г обработали достаточным количеством разбавленной серной кислоты. При этом выделилось 2,24 л газа (н.у.). Найти массовую долю магния в смеси.
1-4.
Смесь цинка и оксида цинка массой 3,08 г растворили в разбавленной серной кислоте. Получили сульфат цинка массой 6,44 г. Вычислите массовую долю цинка в исходной смеси.
1-5.
При действии смеси порошков железа и цинка массой 9,3 г на избыток раствора хлорида меди (II) образовалось 9,6 г меди. Определите состав исходной смеси.
1-6.
Какая масса 20%-ного раствора соляной кислоты потребуется для полного растворения 20 г смеси цинка с оксидом цинка, если при этом выделился водород объемом 4,48 л (н.у.)?
1-7.
При растворении в разбавленной азотной кислоте 3,04 г смеси железа и меди выделяется оксид азота (II) объемом 0,896 л (н.у.). Определите состав исходной смеси.
1-8.
При растворении 1,11 г смеси железных и алюминиевых опилок в 16%-ном растворе соляной кислоты (ρ = 1,09 г/мл) выделилось 0,672 л водорода (н.у.). Найдите массовые доли металлов в смеси и определите объем израсходованной соляной кислоты.
Задачи более сложные.
2-1.
Смесь кальция и алюминия массой 18,8 г прокалили без доступа воздуха с избытком порошка графита. Продукт реакции обработали разбавленной соляной кислотой, при этом выделилось 11,2 л газа (н.у.). Определите массовые доли металлов в смеси.
2-2.
Для растворения 1,26 г сплава магния с алюминием использовано 35 мл 19,6%-ного раствора серной кислоты (ρ = 1,1 г/мл). Избыток кислоты вступил в реакцию с 28,6 мл раствора гидрокарбоната калия с концентрацией 1,4 моль/л. Определите массовые доли металлов в сплаве и объем газа (н.у.), выделившегося при растворения сплава.
2-3.
При растворении 27,2 г смеси железа и оксида железа (II) в серной кислоте и выпаривании раствора досуха образовалось 111,2 г железного купороса — гептагидрата сульфата железа (II). Определите количественный состав исходной смеси.
2-4.
При взаимодействии железа массой 28 г с хлором образовалась смесь хлоридов железа (II) и (III) массой 77,7 г. Вычислите массу хлорида железа (III) в полученной смеси.
2-5.
Чему была равна массовая доля калия в его смеси с литием, если в результате обработки этой смеси избытком хлора образовалась смесь, в которой массовая доля хлорида калия составила 80%?
2-6.
После обработки избытком брома смеси калия и магния общей массой 10,2 г масса полученной смеси твердых веществ оказалась равной 42,2 г. Эту смесь обработали избытком раствора гидроксида натрия, после чего осадок отделили и прокалили до постоянной массы. Вычислите массу полученного при этом остатка.
2-7.
Смесь лития и натрия общей массой 7,6 г окислили избытком кислорода, всего было израсходовано 3,92 л (н.у.). Полученную смесь растворили в 80 г 24,5%-го раствора серной кислоты. Вычислите массовые доли веществ в образовавшемся растворе.
2-8.
Сплав алюминия с серебром обработали избытком концентрированного раствора азотной кислоты, остаток растворили в уксусной кислоте. Объемы газов, выделившихся в обеих реакциях измеренные при одинаковых условиях, оказались равными между собой. Вычислите массовые доли металлов в сплаве.
Три металла и сложные задачи.
3-1.
При обработке 8,2 г смеси меди, железа и алюминия избытком концентрированной азотной кислоты выделилось 2,24 л газа. Такой же объем газа выделяется и при обработке этой же смеси такой же массы избытком разбавленной серной кислоты (н.у.). Определите состав исходной смеси в массовых процентах.
3-2.
14,7 г смеси железа, меди и алюминия, взаимодействуя с избытком разбавленной серной кислоты, выделяет 5,6 л водорода (н.у.). Определите состав смеси в массовых процентах, если для хлорирования такой же навески смеси требуется 8,96 л хлора (н.у.).
3-3.
Железные, цинковые и алюминиевые опилки смешаны в мольном отношении 2:4:3 (в порядке перечисления). 4,53 г такой смеси обработали избытком хлора. Полученную смесь хлоридов растворили в 200 мл воды. Определить концентрации веществ в полученном растворе.
3-4.
Сплав меди, железа и цинка массой 6 г (массы всех компонентов равны) поместили в 18,25 % раствор соляной кислоты массой 160 г. Рассчитайте массовые доли веществ в получившемся растворе.
3-5.
13,8 г смеси, состоящей из кремния, алюминия и железа, обработали при нагревании избытком гидроксида натрия, при этом выделилось 11,2 л газа (н.у.). При действии на такую массу смеси избытка соляной кислоты выделяется 8,96 л газа (н.у.). Определите массы веществ в исходной смеси.
3-6.
При обработке смеси цинка, меди и железа избытком концентрированного раствора щелочи выделился газ, а масса нерастворившегося остатка оказалась в 2 раза меньше массы исходной смеси. Этот остаток обработали избытком соляной кислоты, объем выделившегося газа при этом оказался равным объему газа, выделившегося в первом случае (объемы измерялись при одинаковых условиях). Вычислите массовые доли металлов в исходной смеси.
3-7.
Имеется смесь кальция, оксида кальция и карбида кальция с молярным соотношением компонентов 3:2:5 (в порядке перечисления). Какой минимальный объем воды может вступить в химическое взаимодействие с такой смесью массой 55,2 г?
3-8.
Смесь хрома, цинка и серебра общей массой 7,1 г обработали разбавленной соляной кислотой, масса нерастворившегося остатка оказалась равной 3,2 г. Раствор после отделения осадка обработали бромом в щелочной среде, а по окончании реакции обработали избытком нитрата бария. Масса образовавшегося осадка оказалась равной 12,65 г. Вычислите массовые доли металлов в исходной смеси.
Спортивный сплав
Любой спорт требует подготовки, нередко специальной, так как связан с риском для жизни. Особенно это касается спортивного сплава, направленного на прохождение препятствий. Здесь нужна и выносливость и сила мускул. Есть несколько разновидностей данного туризма:
- гребной сплав по рекам;
- экстремальный;
- свободный стиль на бурной реке.
В гребном сплаве спортсмены соревнуются. Судьи учитывают скорость прохождения дистанции и ее аккуратность. Если задеваются подвесные ворота, то начисляется штраф.Вольный стиль или фристайл, как его называют, подразумевает выполнение трюков на бурной воде. Здесь же учитывается количество и сложность фигур, которые спортсмены успевают сделать за определенное время.