Диаграммы состояния двухкомпонентных систем. Фазы, структуры
Сплавы состоят из двух и более элементов периодической системы. Элементы, образующие сплавы, называют компонентами. Свойства сплава зависят от многих факторов, но, прежде всего они определяются составом фаз и их количественным соотношением.
Зная диаграмму состояния, можно представить полную картину:
- формирования структуры любого сплава;
- определить оптимальную температуру заливки сплава для получения литых деталей;
- оценить жидкотекучесть выбранного сплава и возможность получения химической неоднородности;
- сделать заключение о возможности и условиях обработки давлением;
- определить режим термической обработки, необходимый для данного сплава.
Основные определения.
Диаграмма состояния представляет собой графическое изображение фазового состава сплавов данной системы в функции температуры и химического состава сплава (рис.1, рис.2)
Рис.1 Метод построения диаграмм состояния
Рис.2 Экспериментальная установка для построения диаграмм состояния
где: 1 – печь; 2 – тигель; 3 – расплавленный металл; 4 – горячий спай; 5 – термопара; 6 – колпачок; 7 – холодный спай; 8 гальванометр
Экспериментально построенные диаграммы состояния проверяют по правилу фаз, дающему возможность теоретически обосновать направление протекания процессов превращения для установления равновесного состояния системы.
Правило фаз даёт возможность:
- предсказать и проверить процессы, происходящие в сплавах при нагреве и охлаждении;
- оно показывает, происходит ли процесс кристаллизации при постоянной температуре или в интервале температур;
- указывает, какое число фаз может одновременно существовать в системе.
Правило фаз выражается следующим уравнением:
С = К + 1 – Ф
где: К – число компонентов в системе; Ф – число фаз; С – число степеней свободы (или вариантность системы). Число степеней свободы – это число независимых переменных внутренних (состав фаз) и внешних (температура, давление) факторов, которые можно изменять без изменения числа фаз, находящихся в равновесии.
Диаграмма состояния сплавов, компоненты которых полностью растворимы в жидком и твёрдом состоянии (рис.3).
Имея диаграмму состояния, можно проследить за фазовыми превращениями любого сплава и указать состав и количественное соотношение фаз при любой температуре.
Это осуществляется при помощи двух простых правил (рис.4):
- Правило концентраций – правила определения состава фаз;
- Правило отрезков – правило определения количественного определения фаз.
Рис.3 Диаграмма состояния с неограниченной растворимостью и кривые охлаждения для сплавов и чистых компонентов
Рис.4 Применение правила концентраций и правила отрезков
Диаграмма состояния сплавов, компоненты которых ограниченно растворимы в твёрдом состоянии и образуют эвтектику (рис.5).
Рис.5 Построение кривых охлаждения для диаграммы с ограниченной растворимостью и с эвтектикой
Диаграмма состояния сплавов с ограниченной переменной растворимостью компонентов в твёрдом состоянии (рис.6).
Рис.6 Построение кривых охлаждения для диаграммы с ограниченной переменной растворимостью
Диаграмма состояния сплавов, компоненты которой ограниченно растворимы в твёрдом состоянии и образуют перитектику (рис.7)
Рис.7 Построение кривых охлаждения для диаграмм с перитектикой
Диаграммы состояний сплавов, с полиморфным и эвтектойдным превращением компонентов (рис.8)
Эвтектойдное превращение: γЕ → αК + βF
Рис.8 Построение кривых охлаждения для диаграммы с полиморфным превращением
Диаграммы состояний сплавов, компоненты которых образуют химические соединения (рис.9)
Рис.9 Диаграмма состояния, компоненты которых образуют химические соединения
Физические и механические свойства сплавов в равновесном состоянии.
Свойства сплавов в значительной степени определяется фазовым составом, о котором можно судить по диаграмме состояния (рис.10). Большой практический интерес представляют технологические свойства твёрдых растворов.
Сплавы в состоянии твёрдых растворов хорошо обрабатываются давлением и трудно – резанием. Литейные свойства твёрдых растворов, как правило, не удовлетворительны. Наилучшей жидкотекучестью обладают эвтектические сплавы.
Промежуточные фазы в большинстве случаев обладают высокими твёрдостью, температурой плавления и хрупкостью (карбиды, нитриды, бориды, оксиды и др.).
Закономерности, отмеченные Н.С.Курнаковым, являются основой при разработке составов сплавов с заданными свойствами.
Таким образом, помимо классификации кристаллов по видам связи, используют классификацию по типам кристаллической решётки. Такая классификация позволяет прогнозировать характер изменения свойств сплава в функции состава.
Рис.10 Связь между свойствами сплавов и типом диаграммы состояний (правило Н.С.Курнакова)
Сферы применения
Этот материл применяется в разных отраслях промышленности:
- Смеси и однородный металл применяются в машиностроении. Из них изготавливаются внутренние детали, корпуса, подвижные механизмы.
- Судостроение, самолётостроение, ракетостроение.
- Строительство — изготовление крепежей, расходных материалов.
- Приборостроение — изготовление электроники для дома.
- Радиоэлектроника — создание элементов для электроприборов.
- Медицина, станкостроение, химическая промышленность.
- Изготовление оружия.
Если для чего-то не подходит однородный материал, подойдут соединения на его основе, характеристики которых значительно отличаются.
Диаграмма Fe – C (Fe – Fe3С)
Среди диаграмм состояния металлических сплавов самое большое значение имеет диаграмма состояния системы Fe – C (рис.11). Это объясняется тем, что в технике наиболее широко применяют железоуглеродистые сплавы.
Имеются две диаграммы Fe – C:
- метастабильная Fe – Fe3C;
- стабильная Fe – Гр.
Рис.11 Структурная диаграмма состояний железо углерод
Железо и углерод – компоненты. Железо с температурой плавления 1539оС имеет модификации – α и γ. Модификация Feαсуществует при температурах до 911оС и от 1392оС до 1539оС, имеет ОЦК решётку. Важной особенностью Feαявляется его ферромагнетизм ниже температуры 768оС, называемой точкой Кюри.
Модификация Feγв интервале температур от 911 до 1392оС имеет ГЦК решётку. При переходе Feαв Feγобъем, железа уменьшается приблизительно на 1%. Feγ– парамагнитное (рис.12).
Переход ОЦК ↔ ГЦК называют полиморфным превращением.
Рис.12 Температурный полиморфизм железа
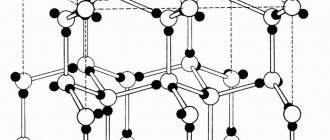
Углерод существует в двух модификациях: графита и алмаза. При равновесных условиях стабилен графит, при высоких давлениях и температурах стабильным становится алмаз.
Фазы в сплавах железо – углерод (рис.13, рис.14):
- жидкий раствор;
- феррит – Ф;
- аустенит – А;
- цементит – Ц;
- свободный углерод в виде – Гр.
Определение фаз в железо – углеродистых сплавах
Рис.13 Фазы в железо – углеродистых сплавах
Рис.14 Кристаллические решётки: a – алмаза, б – графита, с цементита
Превращение в сплавах системы Fe – C:
Первая критическая точка – начало кристаллизации (ликвидус). Эти точки для различных сплавов располагаются на линии АВСД (см. рис. 11).
Вторая критическая точка – конец кристаллизации (солидус). Эти точки для различных сплавов располагаются на линии АНJECF.
Железо – углеродистые сплавы делят на две группы (рис.11):
- стали – сплав железа с углеродом, где углерода содержится до 2,14%;
- чугуны – сплав железа с углеродом, где углерода содержится боле 2,14 %.
В системе Fe – C происходят три изотермических превращения:
- в сталях – перитектическое и эвтектойдное (рис.15, рис.16, рис.17),
- в чугунах – эвтектическое (рис.22)
Рис.15 Кривые охлаждения для сталей с перитектическим превращением
Рис.16 Кривые охлаждения для диаграммы с эвтектойдным превращением
Большинство технологических операций (термическая обработка, обработка стали давлением и др.) проводят в твёрдом состоянии, поэтому более подробно рассматриваются превращения сталей при температурах ниже температур кристаллизации (ниже линии NJE).
На рис.17 изображено превращения в сталях при охлаждении, их структуры и маркировка этих сталей.
Сталь 40 – конструкционная, углеродистая, качественная сталь со средним содержанием углерода 0,40%. Структура – феррит + перлит.
У8 – инструментальная, углеродистая, качественная сталь со средним содержанием углерода 0,8%. Структура – пластинчатый перлит.
У12 – инструментальная, углеродистая, качественная сталь со средним содержанием углерода 1,2%. Структура перлит + сетка цементита.
Рис.17 Кривые охлаждения и структуры сталей
ПРИМЕЧАНИЕ: цементит, выделяющейся из жидкости, называют первичным; цементит, выделяющейся из аустенита – вторичным; цементит, выделяющейся из феррита – третичным.
После освоения материала, превращения в сталях при охлаждении, студент должен самостоятельно описать структуры доэвтектойдных и заэвтектойдных сталей (см. рис.18 и рис.19).
Рис.18 Микроструктуры доэвтектойдных сталей
Рис.19 Микроструктуры эвтектойдной и заэвтектойдной сталей
На диаграмме Fe – C, кроме критических точек ликвидус (начала кристаллизации) и солидус (конец кристаллизации), имеются ещё ряд обозначений критических точек (рис.20).
Рис.20 Обозначения критических точек на диаграмме Fe – С Сильное влияние на свойства сталей оказывают – содержание углеро
да, примеси и температура испытаний стали (рис.21).
Рис.21 Влияние углерода и примесей на свойства сталей
Железоуглеродистые сплавы с эвтектическим превращением (чугуны)
Содержание углерода в этих сплавах более 2,14% (рис.22).
Рис.22 Кривые охлаждения для сплавов с эвтектическим превращением
В сплавах с содержанием углерода более 2,14% С при кристаллизации происходит эвтектическое превращение.
Такие сплавы называют белыми чугунами.
Сплав с концентрацией 4,3% С – эвтектиеский белый чугун кристаллизуется при эвтектической температуре изотермически с одновременным выделением двух фаз: аустенита состава точки Е и цементита. Образующая смесь этих сплавов при Т = 1147оС названа ледебуритом (рис.23).
При дальнейшем охлаждении концентрация углерода в аустените изменяется по линии ЕS вследствие выделения вторичного цементита и к температуре эвтектойдного превращения принимает значение 0,8%. При температуре линии РSК аустенит в ледебурите претерпевает эвтектойдное превращение в перлит.
Рис.23 Микроструктуры белых чугунов Железоуглеродистые сплавы могут кристаллизоваться в соответствии с
диаграммой железо – графит только при весьма медленном охлаждении и наличии графитизирующих добавок Si, Ni, и др. (рис.24). Такие сплавы называют серыми чугунами (рис.25).
Рис.24 Диаграмма состояния системы железо – графит
В зависимости от формы графитных включений серые чугуны называют: обычный серый чугун, ковкий чугун и высокопрочный чугун (рис.25).
Рис.25 Структура серых чугунов
На рис.26, 27 и 28 показана маркировка и металлическая основа серых чугунов.
Рис.26 Микроструктура и маркировка серых чугунов
Рис.27 Режим графитизации белых чугунов, микроструктура и маркировка ковких чугунов
Рис.28 Микроструктура и маркировка высокопрочных чугунов
Ковкие чугуны получают путём отжига белого чугуна, такой отжиг называют – графитизацией белых чугунов. Графитизация делится на несколько стадий в процессе которых цементит полностью распадается на графит.
На рис.29 изображены структуры железоуглеродистых сплавов (феррит – а, доэвтектойдные стали –б, в, эвтектойдная – г, структуры белых чугунов – е, ж, з)
Рис.29 Микроструктуры в железо – углеродистых сплавах
Влияние легирующих элементов на равновесную структуру и свойства сталей.
В качестве легирующих наиболее часто используют следующие элементы: Cr, Ni, Mn, Si, Mo, W, V, Ti, Co, Nb. Реже используются Al, Cu, B и некоторые другие.
Почти все легирующие элементы изменяют:
- температуру полиморфных превращений железа;
- температуру эвтектойдной и эвтектической реакций;
- растворимость углерода в аустените;
- взаимодействия с углеродом образуют карбиды;
- взаимодействия друг с другом или с железом образуют интерметаллиды.
По влиянию на температуры А3и А4легирующие элементы можно разбить на две группы:
- в первую группу входят элементы, которые понижают А3и повышают А4. К ним относятся Ni, Mn, C, N и др. Такие сплавы называют – аустенитными сталями (рис.30);
- во вторую группу входят элементы, которые повышают А3и понижают А4. Таких элементов большинство Cr, Mo, W, V, Si, Ti и др. Такие сплавы называют – ферритными сталями (рис.31)
Рис.30 Стали легированные первой группой элементов (стали аустенитного класса)
Рис.31 Стали легированные второй группой элементов (стали ферритного класса)
Одна группа легирующих элементов не образуют карбидов, а другая группа легирующих элементов могут образовывать карбиды (специальные карбиды), кроме того они могут вступать во взаимодействия с цементитом образуя легированный цементит (рис.32).
Легированный цементит записывают обычно как (Fe, Cr)3 С или (Fe, Mn)3 С или в общем виде Ме3С.
Сильные карбидообразователи – Mo, W, V, Ti – образуют с углеродом фазы внедрения. При этом чаще всего карбиды имеют формулу МС или М2С. Фазы внедрения, отличающиеся очень высокой тугоплавкостью, практически нерастворимы в аустените. Для распада и растворения таких фаз, сталь необходимо нагревать до температур ~ 1300оС. Вследствие нерастворимости фаз внедрения происходит обеднение аустенита углеродом при легировании стали сильными карбидообразователями.
Рис.32 Взаимодействие легирующих элементов с углеродом
Легирующие элементы влияют на температуры фазовых превращений сталей при нагреве и на состав точек S и Е диаграммы (рис.33).
Рис.33 Влияние легирующих элементов на критические точки стали
Под влиянием легирования изменяется положение узловых концентрационных точек диаграммы Fe – С. Большинство легирующих элементов уменьшает растворимость углерода в аустените при всех температурах, что равносильно сдвигу линии SE влево, в сторону меньших концентраций углерода.
Максимальная растворимость углерода в аустените (точка Е) наиболее резко уменьшается под влиянием элементов, замыкающих γ – область в безуглеродистых сплавах: Cr, Si, W, V, Ti. Очевидно, что в присутствии этих легирующих элементов ледебурит в структуре сплава появится при меньших концентрациях углерода, чем не в легированных железоуглеродистых сплавах. Например, в стали, легированной 10 – 11% Cr, ледебурит появляется в структуре при содержании углерода ~ 1%. Характерно, что небольшое количество ледебуритной эвтектике при пониженном содержании углерода не снижает способности сплава обрабатываться давлением в горячем состоянии, тогда как нелегированный белый чугун (С> 2,14%) теряет способность к обработке давлением даже при малых количествах эвтектической составляющей структуре.
В связи с этим легированные стали, содержащие ледебуритную составляющую, относятся к сталям, а не к белым чугунам и классифицируют как ледебуритные.
Получение металла
Есть несколько способов получения железа:
- Прямые способы. Это производство губчатого железа в шахтных и тоннельных печах. Производство железной крицы во вращающихся печах. Возможно получение железа в реакторах кипящего слоя и химико-термический способ.
- Доменный процесс — распространенный метод. Железная руда и флюс восстанавливаются углеродом кокса, в результате получаем чугун. При надобности из чугуна удаляют примеси (фосфор, сера) и избытки углерода в мартеновских печах или в конвертерах. Легированную сталь получают в электрических печах (ЭПС).
- Химически чистое железо можно получить из раствора его солей с помощью электролиза.
Влияние пластической деформации на структуру и свойства деформированного сплава.
Совокупность явлений, связанных с изменением механических, физических и других свойств металлов в процессе пластической деформации называют деформационным упрочнением или наклепом. Упрочнение при наклепе объясняется возрастанием на несколько порядков плотности дислокаций.
С увеличением степени деформации характеристики пластичности (относительное удлинение, относительное сужение) и вязкости (ударная вязкость) уменьшаются, а прочностные характеристики (предел упругости, предел текучести, предел прочности и твердость) увеличиваются (рис.34)
Рис.34 Влияние степени деформации на механические свойства металла
Когда кристаллические решетки большинства зерен получают ещё одинаковую ориентировку, возникает текстура деформации (рис.35)
а
б
Рис.35 Влияние пластической деформации на микроструктуру металла: а – схема, б – микроструктура деформированного металла
Деформированный металл находится в неравновесном состоянии. Переход к равновесному состоянию связан с уменьшением искажений в кристаллической решетке, снятием напряжений, что определяется возможностью перемещения атомов.
При низких температурах подвижность атомов мала, поэтому состояние наклепа может сохраняться неограниченно долго.