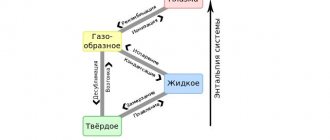
Каждый металл и их сплавы имеют различные свойства. Одно из таких свойств — температура плавления. Каждый металл плавится при разной температуре. Все что нужно для перевода вещества из твёрдого состояния в жидкое — источник тепла, который будет разогревать металл до определенной температуры.
Так как у каждого металла температура плавления различная, можно определить менее устойчивый металл к температуре и более. Так самый легкоплавкий металл — ртуть, он готов перейти в жидкое состоянии при температуре равно 39 градусов по цельсию. А вот вольфрам( из чего собственно и сделаны вольфрамовые электроды для аргоновой сварки), расплавится только по достижению температуры в 3422 градусов цельсии.
Что касается сплавов, таких как сталь и прочих, определить температуру, при которой те будут плавиться, довольно сложно. Вся сложность в их составе… Так как состав разный, то и температура плавления различная. Как правило, для сплавов указывается диапазон температур, при которых он будет плавиться. Вообще, температура плавления металлов интересная тема.
Что такое температура плавления
Каждый металл имеет неповторимые свойства, и в этот список входит температура плавления. При плавке металл уходит из одного состояния в другое, а именно из твёрдого превращается в жидкое. Чтобы сплавить металл, нужно приблизить к нему тепло и нагреть до необходимой температуры – этот процесс и называется температурой плавления. В момент, когда температура доходит до нужной отметки, он ещё может пребывать в твёрдом состоянии. Если продолжать воздействие – металл или сплав начнет плавиться.
Плавление и кипение – это не одно и то же. Точкой перехода вещества из твердого состояния в жидкое, зачастую называют температуру плавления металла. В расплавленном состоянии у молекул нет определенного расположения, но притяжение сдерживает их рядом, в жидком виде кристаллическое тело оставляет объем, но форма теряется.
При кипении объем теряется, молекулы между собой очень слабо взаимодействуют, движутся хаотично в разных направлениях, совершают отрыв от поверхности. Температура кипения – это процесс, при котором давление металлического пара приравнивается к давлению внешней среды.
Для того, чтобы упростить разницу между критическими точками нагрева мы подготовили для вас простую таблицу:
| Свойство | Температура плавки | Температура кипения |
| Физическое состояние | Сплав переходит в расплав, разрушается кристаллическая структура, проходит зернистость | Переходит в состояние газа, некоторые молекулы могут улетать за пределы расплава |
| Фазовый переход | Равновесие между твердым состоянием и жидким | Равновесие давления между парами металла и воздухом |
| Влияние внешнего давления | Нет изменений | Изменения есть, температура уменьшается при разряжении |
Предсказание температуры плавления (критерий Линдемана)
Попытка предсказать точку плавления кристаллических материалов была предпринята в 1910 году Фредериком Линдеманом ( англ. ) [6] . Идея заключалась в наблюдении того, что средняя амплитуда тепловых колебаний увеличивается с увеличением температуры. Плавление начинается тогда, когда амплитуда колебаний становится достаточно большой для того, чтобы соседние атомы начали частично занимать одно и то же пространство.
Критерий Линдемана утверждает, что плавление ожидается, когда среднеквадратическое значение амплитуды колебаний превышает пороговую величину.
Температура плавления кристаллов достаточно хорошо описывается формулой Линдемана [7]:
Tλ=xm29ℏ2MkBθrs2{displaystyle T_{lambda }={frac {x_{m}^{2}}{9hbar ^{2}}}Mk_{B}theta r_{s}^{2}}
где rs{displaystyle r_{s}} — средний радиус элементарной ячейки, θ{displaystyle theta } — температура Дебая, а параметр xm{displaystyle x_{m}} для большинства материалов меняется в интервале 0,15-0,3.
Температура плавления — расчёт
Формула Линдемана выполняла функцию теоретического обоснования плавления в течение почти ста лет, но развития не имела из-за низкой точности.
Тест Агрегатные состояния вещества. Плавление и отвердевание кристаллических тел 8 класс
Тест Агрегатные состояния вещества. Плавление и отвердевание кристаллических тел 8 класс с ответами. Тест включает 18 заданий.
1. Агрегатное состояние вещества – это его пребывание в виде
1) твердого тела 2) жидкого тела 3) газообразного тела 4) какого-либо из этих трех тел
2. В каком агрегатном состоянии могут находиться железо и ртуть?
1) железо в твердом, ртуть в жидком 2) и железо, и ртуть в жидком 3) и железо, и ртуть в твердом 2) оба вещества могут находиться в любом агрегатном состоянии
3. От чего зависит, в каком именно агрегатном состоянии находится вещество?
1) от числа и состава молекул 2) от расположения, взаимодействия и движения молекул 3) от расположения и состава молекул 4) от взаимодействия и числа молекул
4. Что происходит с молекулами вещества при его переходе из одного агрегатного состояния в другое?
1) меняется состав молекул 2) изменяются форма и состав молекул 3) молекулы остаются прежними 4) молекулы приобретают другие размеры
5. Плавление – это
1) таяние снега или льда 2) разжижение вещества, когда оно получает теплоту 3) переход при получении веществом энергии из твердого со- стояния в жидкое
6. Температура, при которой вещество плавится, называется
1) температурой перехода в жидкое состояние 2) температурой плавления 3) температурой таяния
7. Температура плавления цинка 420 °С. В каком состоянии находится этот металл, если его температура 410 °С (№1)? 430 °С (№2)?
1) №1 – твердом, №2 – жидком 2) №1 – жидком, №2 – твердом 3) №1 и №2 – жидком 4) №1 и №2 – твердом
8. Отвердевание – это
1) отдача веществом энергии и превращение в другое вещество 2) переход вещества из жидкого состояния в твердое 3) замерзание воды
9. Как изменяется внутренняя энергия вещества при плавлении? При отвердевании?
1) при плавлении уменьшается, при отвердевании увеличивается 2) не изменяется 3) в том и другом случае возрастает 4) при плавлении увеличивается, при отвердевании уменьшается
10. Температура плавления стали 1500 °С. При какой температуре она отвердевает?
1) при температурах ниже 1500 °С 2) при 1500 °С 3) при температурах выше 1500 °С 4) при любой температуре, если отдает энергию
11. Из какого металла – алюминия, меди или стали – нужно изготовить плавильный сосуд, чтобы расплавить в нем свинец?
1) из алюминия 2) из меди 3) из стали 4) из любого названного
12. В сосуд с расплавленным алюминием упали цинковая и железная пластинки. Какая из них расплавится?
1) цинковая 2) железная 3) никакая 4) обе
13. В каком состоянии будут находиться ртуть и натрий при комнатной температуре (20 °С)?
1) в твердом 2) в жидком 3) ртуть – в жидком, натрий в твердом 4) ртуть в твердом, натрий в жидком
14. На рисунке изображен график нагревания и таяния снега и нагревания полученной из него воды. Какой участок графика соответствует таянию снега? Сколько примерно времени оно длилось? До какой температуры нагрелась вода за 5 мин?
1) ВС; 3,5 мин; 30 °С 2) ВС; 2 мин; 30 °С 3) АВ; 1,5 мин; 30 °С 4) ВС; 3,5 мин; 40 °С
15. Воду из комнаты с температурой 25 °С вынесли на 30-градусный мороз, где она превратилась в лед. График изменения ее температуры и льда показан на рисунке. Какой его участок соответствует отвердеванию воды? О чем свидетельствует участок DE?
1) ВС; о достижении льдом температуры окружающего воздуха и прекращении ее изменения 2) АВ; о выравнивании температур льда и воздуха 3) CD; о том, что температура льда стала равной 30 °С
16. Что происходит с температурой вещества во время его плавления?
1) она понижается 2) повышается 3) остается постоянной
17. Какой из приведенных графиков изменения температуры вещества соответствует процессу его отвердевания, какой нагреванию без перехода в другое агрегатное состояние?
1) №3; №1 2) №2; №3 3) №1; №2 4) №2; №1
18. Какой участок изображенных здесь графиков №1 и №2 изменения температуры вещества соответствует его отвердеванию?
1) АВ 2) FK 3) EF 4) CD
Ответы на тест Агрегатные состояния вещества. Плавление и отвердевание кристаллических тел 8 класс 1-4 2-4 3-2 4-3 5-3 6-2 7-1 8-2 9-4 10-2 11-4 12-1 13-3 14-2 15-1 16-3 17-4 18-2
PDF версия для печати Тест по физике Агрегатные состояния вещества. Плавление и отвердевание кристаллических тел 8 класс (170 Кб)
Графическое представление процессов плавления и отвердевания
График плавления и отвердевания кристаллических тел дает наглядное представление о временной зависимости этих фазовых переходов.
Рис. 2. График плавления и отвердевания вода-лед.
Обычная вода является хорошим примером для иллюстрации обсуждаемых явлений. На представленном графике по оси абсцисс отложено время t, а по оси ординат — температура. Пускай изначально, в момент времени t = 0, когда температура льда (кристалла) была равна -400С, начнется подача тепла — нагрев. Рассмотрим далее временную зависимость температурной зависимости T(t):
- На участке АВ, от -400С до 00С (температура плавления льда) существует лед в кристаллическом виде;
- Участок ВС — происходит стадия плавления, присутствуют одновременно лед и вода. Температура остается постоянной, равной 00С;
- СD — в точке С закончилось плавление, существует только жидкая фаза — вода;
- DЕ — в точке D прекратился нагрев, происходит остывание вплоть до точки Е, т.е. до температуры 00С. Присутствует только вода в жидком виде;
- EF — в точке Е, начинается отвердевание, появляются кристаллы льда, но одновременно присутствует и жидкая фаза. Температура остается постоянной, равной 00С;
- FK — в точке F произошло полное отвердевание, остается только лед в кристаллическом виде, температура которого постепенно понижается.
При какой температуре плавится
Металлические элементы, какими бы они ни были – плавятся почти один в один. Этот процесс происходит при нагреве. Оно может быть, как внешнее, так и внутреннее. Первое проходит в печи, а для второго используют резистивный нагрев, пропуская электричество либо индукционный нагрев. Воздействие выходит практически схожее. При нагреве, увеличивается амплитуда колебаний молекул. Образуются структурные дефекты решётки, которые сопровождаются обрывом межатомных связей. Под процессом разрушения решётки и скоплением подобных дефектов и подразумевается плавление.
У разных веществ разные температуры плавления. Теоретически, металлы делят на:
- Легкоплавкие – достаточно температуры до 600 градусов Цельсия, для получения жидкого вещества.
- Среднеплавкие – необходима температура от 600 до 1600 ⁰С.
- Тугоплавкие – это металлы, для плавления которых требуется температура выше 1600 ⁰С.
Плавление железа
Температура плавления железа достаточно высока. Для технически чистого элемента требуется температура +1539 °C. В этом веществе имеется примесь – сера, а извлечь ее допустимо лишь в жидком виде.
Без примесей чистый материал можно получить при электролизе солей металла.
Плавление чугуна
Чугун – это лучший металл для плавки. Высокий показатель жидкотекучести и низкий показатель усадки дают возможность эффективнее пользоваться им при литье. Далее рассмотрим показатели температуры кипения чугуна в градусах Цельсия:
- Серый – температурный режим может достигать отметки 1260 градусов. При заливке в формы температура может подниматься до 1400.
- Белый – температура достигает отметки 1350 градусов. В формы заливается при показателе 1450.
Важно! Показатели плавления такого металла, как чугун – на 400 градусов ниже, по сравнению со сталью. Это значительно снижает затраты энергии при обработке.
Плавление стали
Плавления стали при температуре 1400 °C
Сталь – это сплав железа с примесью углерода. Её главная польза – прочность, поскольку это вещество способно на протяжении длительного времени сохранять свой объем и форму. Связано это с тем, что частицы находятся в положении равновесия. Таким образом силы притяжения и отталкивания между частицами равны.
Справка! Сталь плавится при 1400 градусах по Цельсию.
Плавление алюминия и меди
Температура плавления алюминия равна 660 градусам, это означает то, что расплавить его можно в домашних условиях.
Чистой меди – 1083 градусов, а для медных сплавов составляет от 930 до 1140 градусов.
Процесс плавления металла
Данный процесс обозначает собой переход вещества из твердого состояния в жидкое. При достижении точки плавления металл может находиться как в твердом, так и в жидком состоянии, дальнейшее возрастание приведет к полному переходу материала в жидкость.
То же самое происходит и при застывании — при достижении границы плавления вещество начнет переходить из жидкого состояния в твердое, и температура не изменится до полной кристаллизации.
При этом следует помнить, что данное правило применимо только для чистого металла. Сплавы не имеют четкой границы температур и совершают переход состояний в некотором диапазоне:
- Солидус — линия температуры, при которой начинает плавиться самый легкоплавкий компонент сплава.
- Ликвидус — окончательная точка плавления всех компонентов, ниже которой начинают появляться первые кристаллы сплава.
Точно измерить температуру плавления таких веществ невозможно, точкой перехода состояний указывается числовой промежуток.
В зависимости от температуры, при которой начинается плавление металлов, их принято разделять на:
- Легкоплавкие, до 600 °C. К ним относятся олово, цинк, свинец и другие.
- Среднеплавкие, до 1600 °C. Большинство распространенных сплавов, и такие металлы как золото, серебро, медь, железо, алюминий.
- Тугоплавкие, свыше 1600 °C. Титан, молибден, вольфрам, хром.
Также существует и температура кипения — точка, при достижении которой расплавленный металл начнет переход в газообразное состояние. Это очень высокая температура, как правило, в 2 раза превышающая точку расплава.
Влияние давления
Температура плавления и равная ей температура затвердевания зависят от давления, возрастая с его повышением. Это обусловлено тем, что при повышении давления атомы сближаются между собой, а для разрушения кристаллической решетки их нужно отдалить. При повышенном давлении требуется большая энергия теплового движения и соответствующая ей температура плавления увеличивается.
Существуют исключения, когда температура, необходимая для перехода в жидкое состояние, при повышенном давлении уменьшается. К таким веществам относят лёд, висмут, германий и сурьма.
Кристаллические решетки металла
В идеальном виде принято считать, что металлам свойственна кубическая решетка (в реальном веществе могут быть изъяны). Между молекулами имеются равные расстояния по горизонтали и вертикали.
Твердое вещество характеризуется постоянством:
- формы, предмет сохраняет линейные размеры в разных условиях;
- объема, предмет не изменяет занимаемое количество вещества;
- массы, количество вещества, выраженное в граммах (килограммах, тоннах);
- плотности, в единице объема содержится постоянная масса.
При переходе в жидкое состояние, достигнув определенной температуры, кристаллические решетки разрушаются. Теперь нельзя говорить о постоянстве формы. Жидкость будет принимать ту форму, в какую ее зальют.
Когда происходит испарение, то постоянным остается только масса вещества. Газ займет весь объем, который будет ему предоставлен. Здесь нельзя утверждать, что плотность постоянная величина.
Когда соединяются жидкости, то возможны варианты:
- Жидкости полностью растворяются одна в другой, так себя ведут вода и спирт. Во всем объеме концентрация веществ будет одинаковой.
- Жидкости расслаиваются по плотности, соединение происходит только на границе раздела. Только временно можно получать механическую смесь. Перемешав разные по свойствам жидкости. Примером является масло и вода.
Металлы образуют сплавы в жидком состоянии. Чтобы получить сплав, каждый из компонентов должен быть в жидком состоянии. У сплавов возможны явления полного растворения одного в другом. Не исключаются варианты, когда сплав будет получен только в результате интенсивного перемешивания. Качество сплава в этом случае не гарантируется, поэтому стараются не смешивать компоненты, которые не позволяют получать стабильные сплавы.
Образующиеся растворимые друг в друге вещества при застывании образуют кристаллические решетки нового типа. Определяют:
- Гелиоцентрированные кристаллические решетки, их еще называют объёмно-центрированными. В середине находится молекула одного вещества, а вокруг располагаются еще четыре молекулы другого. Принято называть подобные решетки рыхлыми, так как в них связь между молекулами металлов слабее.
- Гранецентрированные кристаллические решетки образуют соединения, в которых молекулы компонента располагаются на гранях. Металловеды называют подобные кристаллические сплавы плотными. В реальности плотность сплава может быть выше, чем у каждого из входящих в состав компонентов (алхимики средних веков искали варианты сплавов, при которых плотность будет соответствовать плотности золота).
Прочность металлов
Помимо способности перехода из твердого в жидкое состояние, одним из важных свойств материала является его прочность — возможность твердого тела сопротивлению разрушению и необратимым изменениям формы. Основным показателем прочности считается сопротивление возникающее при разрыве заготовки, предварительно отожженной. Понятие прочности не применимо к ртути, поскольку она находится в жидком состоянии. Обозначение прочности принято в МПа — Мега Паскалях.
Существуют следующие группы прочности металлов:
- Непрочные. Их сопротивление не превышает 50МПа. К ним относят олово, свинец, мягкощелочные металлы
- Прочные, 50−500МПа. Медь, алюминий, железо, титан. Материалы этой группы являются основой многих конструкционных сплавов.
- Высокопрочные, свыше 500МПа. Например, молибден и вольфрам.
Определение удельной теплоты плавления
Удельной теплотой плавления (обозначение – греческая буква “лямбда” – λ ), называется физическая величина равная количеству тепла (в джоулях), которое необходимо передать твердому телу массой 1 кг, чтобы полностью перевести его в жидкую фазу. Формула удельной теплоты плавления выглядит так:
$$ λ ={Q over m}$$
где:
m – масса плавящегося вещества;
Q – количество тепла, переданное веществу при плавлении.
Значения для разных веществ определяют экспериментально.
Зная λ, можно вычислить количество тепла, которое необходимо сообщить телу массой m для его полного расплавления:
$$Q={λ*m}$$
От чего зависит температура плавления
Для разных веществ температура, при которой полностью перестраивается структура до жидкого состояния – разная. Если взять во внимание металлы и сплавы, то стоит подметить такие моменты:
- В чистом виде не часто можно встретить металлы. Температура напрямую зависит от его состава. В качестве примера укажем олово, к которому могут добавлять другие вещества (например, серебро). Примеси позволяют делать материал более либо менее устойчивым к нагреву.
- Бывают сплавы, которые благодаря своему химическому составу могут переходить в жидкое состояние при температуре свыше ста пятидесяти градусов. Также бывают сплавы, которые могут «держаться» при нагреве до трех тысяч градусов и выше. С учетом того, что при изменении кристаллической решетки меняются физические и механические качества, а условия эксплуатации могут определяться температурой нагрева. Стоит отметить, что точка плавления металла – важное свойство вещества. Пример этому – авиационное оборудование.
Термообработка, в большинстве случаев, почти не изменяет устойчивость к нагреву. Единственно верным способом увеличения устойчивости к нагреванию можно назвать внесение изменений в химический состав, для этого и проводят легирование стали.
Кристаллизация
Когда температура жидкости понижается, её молекулы становятся менее подвижными. А силы притяжения, которые удерживают молекулы в определённом строгом порядке, характерном для твёрдого тела, увеличиваются.
Если жидкое вещество охладить до определённой температуры, то оно затвердеет. Процесс фазового перехода из жидкого состояния к твёрдому называется кристаллизацией
. В отличие от плавления, когда вещество получает тепло, при кристаллизации оно его отдаёт, а его температура снижается.
Температура, при которой происходит этот процесс, называется температурой кристаллизации
. Для чистого вещества температура плавления равна температуре кристаллизации.
Как и плавление, кристаллизация также происходит постепенно. Точно так же жидкость и твёрдое вещество будут иметь одинаковую температуру до тех пор, пока не затвердеет всё вещество.
Расплавленное паяльником жидкое олово застывает и становится твёрдым, кода мы убираем паяльник. Расплавленный жидкий металл, разлитый в формы, отвердевает при снижении температуры.
Кристаллизацию в природе мы наблюдаем ежегодно, когда при низкой температуре замерзает вода в водоёмах, на землю вместо капелек дождя падают снежинки.
Почему твердое становится жидким?
Нагревание твердого тела приводит к увеличению кинетической энергии атомов и молекул, которые при нормальной температуре находятся четко в узлах кристаллической решетки, что и позволяет телу сохранять постоянные форму и размеры. При достижении некоторых критических значений скоростей атомы и молекулы начинают покидать свои места, происходит разрыв связей, тело начинает терять свою форму – становится жидким. Процесс плавление происходит не резким скачком, а постепенно, так, что некоторое время твердая и жидкая компоненты (фазы) находятся в равновесии. Плавление относится к эндотермическим процессам, то есть к таким которые происходят с поглощением теплоты. Противоположный процесс, когда жидкость затвердевает называется кристаллизацией.
Рис. 1. Переход твердого, кристаллического, состояния вещества в жидкую фазу.
Было обнаружено, что до окончания процесса плавления температура не изменяется, хотя тепло все время поступает. Никакого противоречия здесь нет, так как поступающая энергия в этот период времени уходит на разрыв кристаллических связей решетки. После разрушения всех связей приток тепла будет повышать кинетическую энергию молекул, а следовательно, температура начнет расти.
Рис. 2. График зависимости температуры тела от времени нагрева.
Плавление
плавление пропана, плавление свинцаПлавле́ние
— это процесс перехода тела из кристаллического твёрдого состояния в жидкое, то есть переход вещества из одного агрегатного состояния в другое.
Плавление происходит с поглощением удельной теплоты плавления
и является фазовым переходом первого рода, которое сопровождается скачкообразным изменением теплоёмкости в конкретной для каждого вещества температурной точке превращения — температура плавления.
Способность плавиться относится к физическим свойствам вещества
При нормальном давлении, наибольшей температурой плавления
среди металлов обладает вольфрам (3422 °C), среди простых веществ — углерод (по разным данным 3500 — 4500 °C) а среди произвольных веществ — карбид тантала-гафния Ta4HfC5 (3942 °C). Можно считать, что самой низкой температурой плавления обладает гелий: при нормальном давлении он остаётся жидким при сколь угодно низких температурах.
Многие вещества при нормальном давлении не имеют жидкой фазы. При нагревании они путем сублимации сразу переходят в газообразное состояние.
- 1 Плавление смесей и твёрдых растворов
- 2 Кинетика плавления 2.1 Природа плавления
- 2.2 Динамика плавления
- 2.3 Плавление в двумерных системах
Плавление смесей и твёрдых растворов
У сплавов, как правило, нет определённой температуры плавления; процесс их плавления происходит в конечном диапазоне температур. На диаграммах состояния «температура — относительная концентрация» имеется конечная область сосуществования жидкого и твёрдого состояния, ограниченная кривыми ликвидуса и солидуса. Аналогичная ситуация имеет место и в случае многих твёрдых растворов.
Фиксированной температуры плавления нет также у аморфных тел; они переходят в жидкое состояние постепенно, размягчаясь при повышении температуры.
Кинетика плавления
Технически плавление вещества осуществляется с помощью подвода тепловой энергии снаружи образца (внешний нагрев, например, в термической печи) или непосредственно во всём его объёме (внутренний нагрев, например, резистивный нагрев при пропускании тока через образец, или индукционный нагрев в высокочастотном электро-магнитном поле). Способ плавления не влияет на основные характеристики процесса — температуру и скрытую теплоту плавления, но определяет внешнюю картину плавления, например, появление квази-жидкого слоя на поверхности образца при внешнем нагреве.
Считается, что плавление характеризуется потерей дальнего ориентационного межатомного порядка в кристалле с переходом к «жидкоподобному» или «газоплотному» беспорядку.
Природа плавления
Поясним вначале, почему при некоторой температуре тело предпочитает разорвать часть межатомных связей и из упорядоченного состояния (кристалл) перейти в неупорядоченное (жидкость).
Как известно из термодинамики, при фиксированной температуре тело стремится минимизировать свободную энергию . При низких температурах второе слагаемое (произведение температуры и энтропии) несущественно, и в результате всё сводится к минимизации обычной энергии .
При этом обычная энергия слегка повысится, но при этом сильно возрастет и энтропия, что в результате приведёт к понижению свободной энергии.
Динамика плавления
В динамике, плавление происходит следующим образом. При повышении температуры тела увеличивается амплитуда тепловых колебаний его молекул, и время от времени возникают структурные дефекты решётки в виде перескоков атомов, роста дислокаций и других нарушений кристаллической решетки.
Каждый такой дефект, возникновение и перемещение дислокаций требуют определённого количества энергии, поскольку сопровождается разрывом некоторых межатомных связей. Стадия рождения и накопления дефектов называется стадией предплавления. Кроме того, на этой стадии, как правило, при внешнем нагреве возникает квази-жидкий слой на поверхности тела.
Считается, что при некоторой температуре концентрация дефектов становится столь большой, что приводит к потере ориентационного порядка в образце.
Температурные колебания атомов в решетке кристалла Поведение жидкости после перехода кристалла через точку плавления, как в среднем постоянные для заданной температуры разрывы и восстановления межкластерных и внутрикластерных межатомных связей (короткие утолщенные отрезки — разорванные связи)
В связи с тем, что механизм термодеструкции кристалла за счёт образования дефектов и роста дислокаций, протекающей в широком диапазоне температур, не приводит к фазовому превращению 1-го рода, то есть к скачку термодинамических характеристик вещества в конкретной для каждого вещества температурной точке, то Линдеман развил простые представления о ходе процесса плавления, согласно которым амплитуда колебания частиц в точке плавления увеличивается настолько, что становится сравнимой с межатомным расстоянием в кристаллической решётке и приводит к разрушению решётки и потере ориентционного межатомного порядка. Фактически этот «фактор плавления» является основой большинства моделей с определяющей ролью отталкивающей части потенциала парного взаимодействия и наложением условий перехода от порядка к «жидкоподобному» или «газоплотному» беспорядку, рассчитываемых методами Монте-Карло и молекулярной динамики. Однако, было установлено, что в точке плавления среднеквадратичное смещение атомов из состояния равновесия составляет всего около 1/8 межатомного расстояния, что исключает модель Линдемана, то есть соударение атомов, как «фактор плавления». При этом энергия атомов существенно ниже потенциальной энергии атомизации кристаллической решётки.
Дальнейшие исследования показали, что динамика плавления кристаллического тела, как фазового превращения 1-го рода, определяется (в отличие от модели накопления дефектов и дислокаций) «катастрофичеким» (crash — ) конформационным преобразованием структуры группы атомов, сопровождаемым разрушением межатомной связи при преодолении потенциального барьера с затратой постоянной величины энергии, ниже энергии атомизации решетки, и равной удельной теплоте плавления.
Этот механизм приводит к подтверждаемой экспериментально кластерной структуре связанного (конденсированного) жидкого состояния с постоянным (для заданной температуры) средним числом разрывающихся и восстанавливающихся межкластерных и внутрикластерных межатомных связей, что определяет подвижность (текучесть) жидкости.
С ростом температуры количество атомов в кластерах уменьшается и при температуре кипения вещество переходит в моноатомное (мономолекулярное) газообразное состояние.
Плавление в двумерных системах
В двумерных или квази-двумерных системах кристалл является гораздо более шатким объектом, чем в трёхмерном случае, а именно у двумерного кристалла нет дальнего позиционного порядка. Для сравнения, в одномерном случае кристалл при конечной температуре вообще не может быть стабильным.
Как выяснилось, это приводит к тому, что плавление двумерного кристалла происходит в два этапа. Вначале кристалл переходит в так называемую гексатическую фазу, в которой теряется ближний позиционный порядок, но сохраняется ориентационный, а затем происходит потеря и ориентационного порядка и тело становится жидким.
Примечания
- ↑
С. Т. Жуков Химия 8-9 класс, Глава 1. Основные представления и понятия химии - ↑
Разброс экспериментальных данных связан, по видимому, с фазовым переходом графит-карбин и различной скоростью нагрева при измерениях. Климовский И. И., Марковец В. В.Влияние фазового перехода графит-карбин на излучательную способность графитовых образцов при их нагревании до температур 3000 K и более // International Scientific Journal for Alternative Energy and Ecology. — 2007. — № 6 (50). — С. 50-59.
- ↑
Мейер К. Физико-химическая кристаллография, М., «Металлография», 1972
- ↑
LindemannF.A. // Phys.Z., 1910, v.11, p.609 - ↑
Wood W. W., Jacobson J. D. Preliminary Results from a Recalculation of the Monte Carlo Equation of State of Hard Spheres // J. Chem. Phys.. — 1957. — № 27. — С. 1207. — DOI:10.1063/1.1743956. - ↑
Alder B. J., Wainwright T. E. Phase Transition in Elastic Disks // Phys. Rev.. — 1962. — № 127. — С. 359. — DOI:10.1103/PhysRev.127.359.
- ↑
Hoover W. G., Gray S. G., Johnson K. W. Thermodynamic Properties of the Fluid and Solid Phases for Inverse Power Potentials // J. Chem. Phys.. — 1971. — № 55. — С. 1128. — DOI:10.1063/1.1676196.
- ↑
Пайнс Д. Элементарные возбуждения в твёрдых телах. М., Мир, 1965.
Ссылки
- Поверхностное предплавление льда
- Плавление двумерных кристаллов
плавление воды, плавление льда, плавление металлов, плавление пропана, плавление свинца
Плавление Информацию О
Плавление
Плавление Плавление Вы просматриваете субъект Плавление что, Плавление кто, Плавление описание
There are excerpts from wikipedia on this article and video
Наш сайт имеет систему в функции поисковой системы. Выше: «что вы искали?»вы можете запросить все в системе с коробкой. Добро пожаловать в нашу простую, стильную и быструю поисковую систему, которую мы подготовили, чтобы предоставить вам самую точную и актуальную информацию.
Поисковая система, разработанная для вас, доставляет вам самую актуальную и точную информацию с простым дизайном и системой быстрого функционирования. Вы можете найти почти любую информацию, которую вы ищете на нашем сайте.
На данный момент мы служим только на английском, турецком, русском, украинском, казахском и белорусском языках. Очень скоро в систему будут добавлены новые языки.
Жизнь известных людей дает вам информацию, изображения и видео о сотнях тем, таких как политики, правительственные деятели, врачи, интернет-сайты, растения, технологические транспортные средства, автомобили и т. д.
Таблица температур плавления
Узнать какая нужна температура для плавления металлов, поможет таблица по возрастанию температурных показателей.
| Элемент или соединение | Необходимый температурный режим |
| Литий | +18°С |
| Калий | +63,6°С |
| Индий | +156,6°С |
| Олово | +232°С |
| Таллий | +304°С |
| Кадмий | +321°С |
| Свинец | +327°С |
| Цинк | +420°С |
Таблица плавления среднеплавких металлов и сплавов.
| Элемент либо сплав | Температурный режим |
| Магний | +650°С |
| Алюминий | +660°С |
| Барий | +727°С |
| Серебро | +960°С |
| Золото | +1063°С |
| Марганец | +1246°С |
| Медь | +1083°С |
| Никель | +1455°С |
| Кобальт | +1495°С |
| Железо | +1539°С |
| Дюрали | +650°С |
| Латуни | +950…1050°С |
| Чугун | +1100…1300°С |
| Углеродистые стали | +1300…1500°С |
| Нихром | +1400°С |
Таблица плавления тугоплавких металлов и сплавов.
| Наименование элемента | Температурный режим |
| Титан | +1680°С |
| Платина | +1769,3°С |
| Хром | +1907°С |
| Цирконий | +1855°С |
| Ванадий | +1910°С |
| Иридий | +2447°С |
| Молибден | +2623°С |
| Тантал | +3017°С |
| Вольфрам | +3420°С |
Классификация металлов по температуре плавления
В физике переход твердого тела в жидкое состояние характерен только для веществ кристаллической структуры. Температуру плавления металлов чаще обозначают диапазоном значений, для сплавов точно определить нагрев до пограничного фазового состояния сложно. Для чистых элементов каждый градус имеет значение, особенно, если это легкоплавкие элементы,
значения не имеет. Сводная таблица показателей t обычно делится на 3 группы. Помимо легкоплавких элементов, которые максимально нагревают до +600°С, указывают тугоплавкие, выдерживающие нагрев свыше +1600°С, и среднеплавкие. В этой группе сплавы, образующие ванну расплава при температуре от +600 до 1600°С.
Легкоплавкие металлы
Легкоплавкие металлы имеют температуру плавления ниже 600°C. Это цинк, олово, висмут. Такие металлы можно расплавить в домашних условиях , разогрев их на плите, или с помощью паяльника. Легкоплавкие металлы используются в электронике и технике для соединения металлических элементов и проводов для движения электрического тока. Температура плавления олова составляет 232 градуса, а цинка – 419.
Таблица легкоплавких металлов и сплавов (до 600С о )
| Название элемента | Латинское обозначение | Температуры | |
| Плавления | Кипения | ||
| Олово | Sn | 232 Со | 2600 Со |
| Свинец | Pb | 327 Со | 1750 Со |
| Цинк | Zn | 420 Со | 907 Со |
| Калий | K | 63,6 Со | 759 Со |
| Натрий | Na | 97,8 Со | 883 Со |
| Ртуть | Hg | — 38,9 Со | 356.73 Со |
| Цезий | Cs | 28,4 Со | 667.5 Со |
| Висмут | Bi | 271,4 Со | 1564 Со |
| Палладий | Pd | 327,5 Со | 1749 Со |
| Полоний | Po | 254 Со | 962 Со |
| Кадмий | Cd | 321,07 Со | 767 Со |
| Рубидий | Rb | 39,3 Со | 688 Со |
| Галлий | Ga | 29,76 Со | 2204 Со |
| Индий | In | 156,6 Со | 2072 Со |
| Таллий | Tl | 304 Со | 1473 Со |
| Литий | Li | 18,05 Со | 1342 Со |
Среднеплавкие металлы
Среднеплавкие металлы начинают переходить из твердого в жидкое состояние при температуре от 600°C до 1600°C. Они используются для изготовления плит, арматур, блоков и других металлических конструкций, пригодных для строительства. К этой группе металлов относятся железо, медь, алюминий, они также входят в состав многих сплавов. Медь добавляют в сплавы драгоценных металлов, таких как золото, серебро, платина. Золото 750 пробы на 25% состоит из лигатурных металлов, в том числе и меди, которая придает ему красноватый оттенок. Температура плавления этого материала равна 1084 °C. А алюминий начинает плавиться при относительно низкой температуре, составляющей 660 градусов Цельсия. Это легкий пластичный и недорогой металл, который не окисляется и не ржавеет, поэтому широко используется при изготовлении посуды. Температура плавления железа равна 1539 градусов. Это один из самых популярных и доступных металлов, его применение распространено в строительстве и автомобильной промышленности. Но ввиду того, что железо подвергается коррозии, его нужно дополнительно обрабатывать и покрывать защитным слоем краски, олифы или не допускать попадания влаги.
Таблица среднеплавких металлов и сплавов (от 600С о до 1600С о )
| Название элемента | Латинское обозначение | Температура | |
| Плавления | Кипения | ||
| Алюминий | Al | 660 Со | 2519 Со |
| Германий | Ge | 937 Со | 2830 Со |
| Магний | Mg | 650 Со | 1100 Со |
| Серебро | Ag | 960 Со | 2180 Со |
| Золото | Au | 1063 Со | 2660 Со |
| Медь | Cu | 1083 Со | 2580 Со |
| Железо | Fe | 1539 Со | 2900 Со |
| Кремний | Si | 1415 Со | 2350 Со |
| Никель | Ni | 1455 Со | 2913 Со |
| Барий | Ba | 727 Со | 1897 Со |
| Бериллий | Be | 1287 Со | 2471 Со |
| Нептуний | Np | 644 Со | 3901,85 Со |
| Протактиний | Pa | 1572 Со | 4027 Со |
| Плутоний | Pu | 640 Со | 3228 Со |
| Актиний | Ac | 1051 Со | 3198 Со |
| Кальций | Ca | 842 Со | 1484 Со |
| Радий | Ra | 700 Со | 1736,85 Со |
| Кобальт | Co | 1495 Со | 2927 Со |
| Сурьма | Sb | 630,63 Со | 1587 Со |
| Стронций | Sr | 777 Со | 1382 Со |
| Уран | U | 1135 Со | 4131 Со |
| Марганец | Mn | 1246 Со | 2061 Со |
| Константин | 1260 Со | ||
| Дуралюмин | Сплав алюминия, магния, меди и марганца | 650 Со | |
| Инвар | Сплав никеля и железа | 1425 Со | |
| Латунь | Сплав меди и цинка | 1000 Со | |
| Нейзильбер | Сплав меди, цинка и никеля | 1100 Со | |
| Нихром | Сплав никеля, хрома, кремния, железа, марганца и алюминия | 1400 Со | |
| Сталь | Сплав железа и углерода | 1300 Со — 1500 Со | |
| Фехраль | Сплав хрома, железа, алюминия, марганца и кремния | 1460 Со | |
| Чугун | Сплав железа и углерода | 1100 Со — 1300 Со | |
Тугоплавкие металлы
Температура тугоплавких металлов выше 1600°C. Это вольфрам, титан, платина, хром и другие. Их используют в качестве источников света, машинных деталей, смазочных материалов, а также в ядерной промышленности. Из них изготавливают проволоки, высоковольтные провода и используют для расплавки других металлов с более низкой температурой плавления. Платина начинает переходить из твердого в жидкое состояние при температуре 1769 градусов, а вольфрам – при температуре 3420°C.
Ртуть – единственный металл, находящийся в жидком состоянии при обычных условиях, а именно, нормальном атмосферном давлении и средней температуре окружающей среды. Температура плавления ртути составляет минус 39°C. Этот металл и его пары являются ядовитыми, поэтому он используется только в закрытых емкостях или в лабораториях. Распространенное применение ртути – градусник для измерения температуры тела.
Каждый металл и сплав имеет собственный уникальный набор физических и химических свойств, среди которых не последнее место занимает температура плавления. Сам процесс означает переход тела из одного агрегатного состояния в другое, в данном случае, из твердого кристаллического состояния в жидкое. Чтобы расплавить металл, необходимо подводить к нему тепло до достижения температуры плавления. При ней он все еще может оставаться в твердом состоянии, но при дальнейшем воздействии и повышении тепла металл начинает плавиться. Если температуру понизить, то есть отвести часть тепла, элемент затвердеет.
Самая высокая температура плавления среди металлов принадлежит вольфраму: она составляет 3422С о , самая низкая — у ртути: элемент плавится уже при — 39С о . Определить точное значение для сплавов, как правило, не представляет возможности: оно может значительно колебаться в зависимости от процентного соотношения компонентов. Их обычно записывают в виде числового промежутка.
Таблица тугоплавких металлов и сплавов (свыше 1600С о )
| Название элемента | Латинское обозначение | Температуры | |
| Плавления | Кипения | ||
| Вольфрам | W | 3420 Со | 5555 Со |
| Титан | Ti | 1680 Со | 3300 Со |
| Иридий | Ir | 2447 Со | 4428 Со |
| Осмий | Os | 3054 Со | 5012 Со |
| Платина | Pt | 1769,3 Со | 3825 Со |
| Рений | Re | 3186 Со | 5596 Со |
| Хром | Cr | 1907 Со | 2671 Со |
| Родий | Rh | 1964 Со | 3695 Со |
| Рутений | Ru | 2334 Со | 4150 Со |
| Гафний | Hf | 2233 Со | 4603 Со |
| Тантал | Ta | 3017 Со | 5458 Со |
| Технеций | Tc | 2157 Со | 4265 Со |
| Торий | Th | 1750 Со | 4788 Со |
| Ванадий | V | 1910 Со | 3407 Со |
| Цирконий | Zr | 1855 Со | 4409 Со |
| Ниобий | Nb | 2477 Со | 4744 Со |
| Молибден | Mo | 2623 Со | 4639 Со |
| Карбиды гафния | 3890 Со | ||
| Карбиды ниобия | 3760 Со | ||
| Карбиды титана | 3150 Со | ||
| Карбиды циркония | 3530 Со | ||
Удельная теплота плавления некоторых веществ
Информацию о значениях удельной теплоты для конкретного вещества можно найти в книжных справочниках или в электронных версиях на интернет-ресурсах. Обычно они приводятся в виде таблицы:
Удельная теплота плавления веществ
| Вещество | 105 * Дж/кг | ккал/кг | Вещество | 105 * Дж/кг | ккал/кг |
| Алюминий | 3,8 | 92 | Ртуть | 0,1 | 3,0 |
| Железо | 2,7 | 65 | Свинец | 0,3 | 6,0 |
| Лед | 3,3 | 80 | Серебро | 0,87 | 21 |
| Медь | 1,8 | 42 | Сталь | 0,8 | 20 |
| Нафталин | 1,5 | 36 | Цинк | 1,2 | 28 |
| Олово | 0,58 | 14 | Платина | 1,01 | 24,1 |
| Парафин | 1,5 | 35 | Золото | 0,66 | 15,8 |
Одним из самых тугоплавких веществ является карбид тантала – TаC. Он плавится при температуре 39900С. Покрытия из TаC применяют для защиты металлических в форм, в которых отливают детали из алюминия.
Рис. 3. Процесс плавки металла.
У какого металла самая высокая температура плавления
Вольфрам – самый тугоплавкий металл, 3422 °C (6170 °F).
Твердый, тугоплавкий, достаточно тяжелый материал светло-серого цвета, который имеет металлический блеск. Механической обработке поддается с трудом. При комнатной температуре достаточно хрупок и ломается. Ломкость металла связана с загрязнением примесями углерода и кислорода.
Примечание! Технически, чистый металл при температуре выше четырехсот градусов по Цельсию становится очень пластичным. Демонстрирует химическую инертность, неохотно вступает в реакции с другими элементами. В природе встречается в виде таких сложных минералов, как: гюбнерит, шеелит, ферберит и вольфрамит.
Вольфрам можно получить из руды, благодаря сложным химическим переработкам, в качестве порошка. Используя прессование и спекание, из него создают детали обычной формы и бруски.
Вольфрам — крайне стойкий элемент к любым температурным воздействиям. По этой причине размягчить вольфрам не могли более сотни лет. Не существовало такой печи, которая смогла бы нагреться до нескольких тысяч градусов по Цельсию. Ученым удалось доказать, что это самый тугоплавкий металл. Хотя бытует мнение, что сиборгий, по некоторым теоретическим данным, имеет большую тугоплавкость, но это лишь предположение, поскольку он является радиоактивным элементом и у него небольшой срок существования.