Почему твердое становится жидким?
Нагревание твердого тела приводит к увеличению кинетической энергии атомов и молекул, которые при нормальной температуре находятся четко в узлах кристаллической решетки, что и позволяет телу сохранять постоянные форму и размеры. При достижении некоторых критических значений скоростей атомы и молекулы начинают покидать свои места, происходит разрыв связей, тело начинает терять свою форму — становится жидким. Процесс плавление происходит не резким скачком, а постепенно, так, что некоторое время твердая и жидкая компоненты (фазы) находятся в равновесии. Плавление относится к эндотермическим процессам, то есть к таким которые происходят с поглощением теплоты. Противоположный процесс, когда жидкость затвердевает называется кристаллизацией.
Рис. 1. Переход твердого, кристаллического, состояния вещества в жидкую фазу.
Было обнаружено, что до окончания процесса плавления температура не изменяется, хотя тепло все время поступает. Никакого противоречия здесь нет, так как поступающая энергия в этот период времени уходит на разрыв кристаллических связей решетки. После разрушения всех связей приток тепла будет повышать кинетическую энергию молекул, а следовательно, температура начнет расти.
Рис. 2. График зависимости температуры тела от времени нагрева.
Общие характеристики свинца
Свинец один из самых распространенных металлов на земле. Он широко распространен на планете, в общем, этим и объясняется его широкое применение человечеством с древнейших времен. Металл имеет большую удельную массу, но при этом он довольно мягкий и легко поддается обработке. Плотность металла зависит от температуры, чем выше температура, тем меньше плотность. При большой удельной плотности он все равно остается мягким, на его поверхности легко оставить оттиск даже ногтем.
Металл имеет не слишком выразительный вид, при ковке или фрезеровке он быстро теряет блеск из-за активно восстанавливающийся оксидной пленки на поверхности. Он относится к категории тяжелых металлов. Удельная плотность при комнатной температуре в 20 градусов равна 11,34 г/куб см.
Отличительным свойством металла выступает его небольшая температура плавления. Дело в том, что, несмотря на столь солидную удельную плотность и принадлежность к тяжелым металлам температура плавления свинца составляет всего 327,46 С. Кроме этого добавление в состав свинца других тугоплавких металлов не обеспечивает изменение его пластичности.
Слитки свинца
В качестве конструкционного металла свинец абсолютно не годится. Механические свойства металла не могут похвастаться высокими показателями:
- Предел твердости по шкале Бринелля составляет 3,2-3,28 Нв;
- Предел прочности при механическом сжатии достигается при усилии 50МПа;
- Предельным показателем сопротивления на разрыв составляет всего 13 Мпа.
Также металл обладает низкой теплопроводностью, он почти в 2 раза ниже, чем у железа и в 11 раз чем у меди – 33,5 вт/(м*К). Теплоемкость металла при 20 градусах составляет 0,128 кДж/(кг*К).
Свинец не самый лучший проводник электричества – удельное сопротивление составляет 0,22 Ом/мм2.
А вот относительно коррозионной стойкости, то хоть он и не относится к благородным металлам, у него довольно высокая. Свинец в чистом виде, без оксидной пленки пребывает при температуре 850 градусов, так что защитная оксидная пленка на металле и выступает главным препятствием для коррозии.
При нормальных условиях, металл практически неуязвим для обычных источников коррозии, а вот в разбавленной азотной кислоте концентрацией меньше 70% он быстро разрушается. Хотя к сернистой, уксусной, плавиковой и фосфорной кислоте он нейтрален. Еще одним веществом, разрушающим оксидную пленку на металле, выступает серная (90%) кислота. При контактах с другими металлами процесс коррозии начинается при обычных условиях, правда с железом и медью такой реакции не возникает.
Определение удельной теплоты плавления
Удельной теплотой плавления (обозначение — греческая буква “лямбда” – λ ), называется физическая величина равная количеству тепла (в джоулях), которое необходимо передать твердому телу массой 1 кг, чтобы полностью перевести его в жидкую фазу. Формула удельной теплоты плавления выглядит так:
$$ λ ={Q \over m}$$
где:
m — масса плавящегося вещества;
Q — количество тепла, переданное веществу при плавлении.
Значения для разных веществ определяют экспериментально.
Зная λ, можно вычислить количество тепла, которое необходимо сообщить телу массой m для его полного расплавления:
$$Q={λ*m}$$
Предсказание температуры плавления (критерий Линдемана)
Попытка предсказать точку плавления кристаллических материалов была предпринята в 1910 году Фредериком Линдеманом (англ.). Идея заключалась в наблюдении того, что средняя амплитуда тепловых колебаний увеличивается с увеличением температуры. Плавление начинается тогда, когда амплитуда колебаний становится достаточно большой для того, чтобы соседние атомы начали частично занимать одно и то же пространство.
Критерий Линдемана
утверждает, что плавление ожидается, когда среднеквадратическое значение амплитуды колебаний превышает пороговую величину.
Температура плавления кристаллов достаточно хорошо описывается формулой Линдемана:
Tλ=xm29ℏ2MkBθrs2{\displaystyle T_{\lambda }={\frac {x_{m}^{2}}{9\hbar ^{2}}}Mk_{B}\theta r_{s}^{2}}
где rs{\displaystyle r_{s}} — средний радиус элементарной ячейки, θ{\displaystyle \theta } — температура Дебая, а параметр xm{\displaystyle x_{m}} для большинства материалов меняется в интервале 0,15-0,3.
Температура плавления — Расчет
Формула Линдемана выполняла функцию теоретического обоснования плавления в течение почти ста лет, но развития не имела из-за низкой точности.
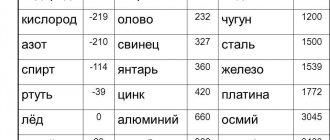
Удельная теплота плавления некоторых веществ
Информацию о значениях удельной теплоты для конкретного вещества можно найти в книжных справочниках или в электронных версиях на интернет-ресурсах. Обычно они приводятся в виде таблицы:
Удельная теплота плавления веществ
| Вещество | 105 * Дж/кг | ккал/кг | Вещество | 105 * Дж/кг | ккал/кг |
| Алюминий | 3,8 | 92 | Ртуть | 0,1 | 3,0 |
| Железо | 2,7 | 65 | Свинец | 0,3 | 6,0 |
| Лед | 3,3 | 80 | Серебро | 0,87 | 21 |
| Медь | 1,8 | 42 | Сталь | 0,8 | 20 |
| Нафталин | 1,5 | 36 | Цинк | 1,2 | 28 |
| Олово | 0,58 | 14 | Платина | 1,01 | 24,1 |
| Парафин | 1,5 | 35 | Золото | 0,66 | 15,8 |
Одним из самых тугоплавких веществ является карбид тантала — TаC. Он плавится при температуре 39900С. Покрытия из TаC применяют для защиты металлических в форм, в которых отливают детали из алюминия.
Рис. 3. Процесс плавки металла.
Примечания
- С. Т. Жуков Химия 8-9 класс, Глава 1. Основные представления и понятия химии
- Разброс экспериментальных данных связан, по видимому, с фазовым переходом графит-карбин и различной скоростью нагрева при измерениях. Климовский И. И., Марковец В. В.
Влияние фазового перехода графит-карбин на излучательную способность графитовых образцов при их нагревании до температур 3000 K и более // International Scientific Journal for Alternative Energy and Ecology. — 2007. — № 6 (50). — С. 50-59. - Андреев В. Д.
Избранные проблемы теоретической физики.. — Киев: Аванпост-Прим,. — 2012. - Мейер К. Физико-химическая кристаллография, М., «Металлография», 1972
- Lindemann F. A. // Phys.Z., 1910, v.11, p.609
- Wood W. W., Jacobson J. D.
Preliminary Results from a Recalculation of the Monte Carlo Equation of State of Hard Spheres // J. Chem. Phys.. — 1957. — № 27. — С. 1207. — DOI:10.1063/1.1743956. - Alder B. J., Wainwright T. E.
Phase Transition in Elastic Disks // Phys. Rev.. — 1962. — № 127. — С. 359. — DOI:10.1103/PhysRev.127.359. - Hoover W. G., Gray S. G., Johnson K. W.
Thermodynamic Properties of the Fluid and Solid Phases for Inverse Power Potentials // J. Chem. Phys.. — 1971. — № 55. — С. 1128. — DOI:10.1063/1.1676196. - Пайнс Д. Элементарные возбуждения в твёрдых телах. М., Мир, 1965.
- Андреев В. Д.
Крэш (crash)-конформационная кинематика ковалентной решетки алмаза при плавлении. // Журнал структурной химии. — 2001. — № 3. — С. 486-495. - Андреев В. Д.
«Фактор плавления» при межатомных взаимодействиях в алмазной решетке. // Химическая физика. — 2002. — № 8,т.21. — С. 35-40.
Свойства тугоплавких металлов и сплавов
Примеры
Кристаллизация – это в химии очень тщательно изучаемый процесс, который особенно интересен на практике.
В качестве примера можно рассмотреть процесс образования сахара. Суть процесса заключается в выделении сахарозы, содержащейся в сиропе. Последний, в свою очередь, содержит также другие вещества, которые не были удалены в процессе очистки сока, и вновь образовались по ходу сгущения.
Когда поднимается температура, кристаллизация начинается, и в ее процессе образуется межкристальный раствор, который называется утфель. Все лишние вещества будут скапливаться в нем. На самом деле, они серьезно затрудняют весь процесс, поскольку наличие различного рода примесей увеличивает вязкость раствора.
Еще один яркий пример кристаллизации в химии связан с образованием соли. Для того чтобы его увидеть воочию, даже не нужно проводить экспериментов – данный процесс существует в природе. В холодное время года прибой выбрасывает на берег тонны соли. Она не пропадает. Ее сгребают в огромные кучи, а потом, когда наступает жара и сухость, из нее испаряется кристаллизационная вода. Остается лишь мелкий порошок – соль, потребляемая промышленностью.
Пример с солью – самый простой. Даже в некоторых школах детям дают на дом задание в рамках урока химии: растворить в совсем небольшом количестве воды 1-2 ложки соли и оставить емкость где-нибудь. Для более интенсивной кристаллизации температуру можно увеличить – пододвинуть раствор к батарее, например. Через пару дней вода испарится. А вот солевые кристаллы останутся.
Предсказание температуры плавления (критерий Линдемана)
Попытка предсказать точку плавления кристаллических материалов была предпринята в 1910 году Фредериком Линдеманом (англ.). Идея заключалась в наблюдении того, что средняя амплитуда тепловых колебаний увеличивается с увеличением температуры. Плавление начинается тогда, когда амплитуда колебаний становится достаточно большой для того, чтобы соседние атомы начали частично занимать одно и то же пространство.
Критерий Линдемана
утверждает, что плавление ожидается, когда среднеквадратическое значение амплитуды колебаний превышает пороговую величину.
Температура плавления кристаллов достаточно хорошо описывается формулой Линдемана:
Tλ=xm29ℏ2MkBθrs2{\displaystyle T_{\lambda }={\frac {x_{m}^{2}}{9\hbar ^{2}}}Mk_{B}\theta r_{s}^{2}}
где rs{\displaystyle r_{s}} — средний радиус элементарной ячейки, θ{\displaystyle \theta } — температура Дебая, а параметр xm{\displaystyle x_{m}} для большинства материалов меняется в интервале 0,15-0,3.
Температура плавления – Расчет
Формула Линдемана выполняла функцию теоретического обоснования плавления в течение почти ста лет, но развития не имела из-за низкой точности.
В 1999г. И.В. Гаврилиным было получено новое выражение для расчёта температуры плавления:
Тпл = DHпл / 1,5 N k
, (1)
где Тпл
– температура плавления;
DHпл –
скрытая теплота плавления;
N
– скрытая теплота плавления;
k
– константа Больцмана.
Впервые получено исключительно компактное выражение (1) для расчёта температуры плавления металлов, связывающее эту температуру с известными физическими константами: скрытой теплотой плавления, числом Авогадро и константой Больцмана.
Точность расчетов по (1) можно оценить по данным таблицы.
Таблица.
Температура плавления некоторых металлов. Расчет по (1)
| Me | Al | V | Mn | Fe | Ni | Cu | Zn | Sn | Mo |
| DHпл ккал моль-1 | 2,5 | 5,51 | 3,5 | 4,4 | 4,18 | 3,12 | 1,7 | 1,7 | 8,7 |
| Тпл, К по (1) | 876 | 1857 | 1179 | 1428 | 1406 | 1051 | 583 | 529 | 2945 |
| Тпл, К Эксп. | 933 | 2190 | 1517 | 1811 | 1728 | 1357 | 692 | 505 | 2890 |
По этим данным, точность расчетов Тпл меняется от 2 до 30%, что в расчетах такого рода вполне приемлемо.
Формула (1) выведена как одно из следствий новой теории плавления и кристаллизации, опубликованной в 2000г..
— Гаврилин И.В. Плавление и кристаллизация металлов и сплавов. Изд. ВлГУ. Владимир. 2000. 256 с.
Изотермический способ и высаливание
Об этом тоже следует рассказать. Изотермический процесс кристаллизации характеризуется испарением воды из растворов при постоянной, не меняющейся температуре. Этот метод применим для веществ с содержанием солей, растворимость которых практически не зависит от нагревания.
Испарения удается добиться за счет доведения жидкости до интенсивного кипения и поддержания ее в таком состоянии. Это «традиционный» метод. Еще может использоваться медленное поверхностное испарение.
В некоторых случаях в жидкости вводят вещества, которые понижают их способность к растворению. Это называется высаливанием. Такими «помощниками» являются вещества, в которых содержится одинаковый с данной солью ион. Яркий пример: процесс кристаллизации хлорида натрия из раствора с высокой концентрацией, в который добавляют хлорид магния.
Следует оговориться, что механизм высаливания не всегда одинаков. Если в целях проведения данного процесса смешать два электролита, добавочный из которых будет с одноименным ионом, то в итоге получится добиться такой концентрации, что произведение растворимости вещества станет значительно выше. Что это значит? Говоря простыми словами – появится избыток вещества, и он выделится в твердую фазу.
Бывает и по-другому. Чтобы добиться высаливания, приходится и вовсе менять структуру раствора – способствовать образованию гидратных оболочек вокруг частиц вещества, которое необходимо кристаллизовать. Как это достигается? Посредством разрушения оболочек у уже растворенного вещества.
Важно усвоить: соли, которые образуют кристаллогидраты, высаливаются интенсивнее, чем те, которые образуются в безводной форме. Но некоторые «добавки» лишь усиливают растворимость
Это приводит к всаливанию.
Примечания
- Дрица М. Е., Будберг П. Б., Бурханов Г. С., Дриц А. М., Пановко В. М.
Свойства элементов. — Металлургия, 1985. — С. 672. - ↑ , p. 4.122.
- Температура плавления очищенной воды была измерена как 0,002519 ± 0,000002 °C, см.
- Agte, C.; Alterthum, H.
Researches on Systems with Carbides at High Melting Point and Contributions to the Problem of Carbon Fusion (англ.) // Z. Tech. Phys. : journal. — 1930. — Vol. 11. — P. 182—191. - Lindemann FA (англ.)русск..
The calculation of molecular vibration frequencies (нем.) // Phys. Z. : magazin. — 1910. — Bd. 11. — S. 609—612. - Жирифалько Л.
Статистическая физика твердого тела. — М.: Мир, 1975. — С. 15. - Гаврилин И. В.
3.7. Расчёт температуры плавления металлов // Плавление и кристаллизация металлов и сплавов. — Владимир: Изд. ВлГУ, 2000. — С. 72. — 200 экз. — ISBN 5-89368-175-4.