Взаимодействие алюминия с простыми веществами
с кислородом
При контакте абсолютно чистого алюминия с воздухом атомы алюминия, находящиеся в поверхностном слое, мгновенно взаимодействуют с кислородом воздуха и образуют тончайшую, толщиной в несколько десятков атомарных слоев, прочную оксидную пленку состава Al2O3, которая защищает алюминий от дальнейшего окисления. Невозможно и окисление крупных образцов алюминия даже при очень высоких температурах. Тем не менее, мелкодисперсный порошок алюминия довольно легко сгорает в пламени горелки:
с галогенами
Алюминий очень энергично реагирует со всеми галогенами. Так, реакция между перемешанными порошками алюминия и йода протекает уже при комнатной температуре после добавления капли воды в качестве катализатора. Уравнение взаимодействия йода с алюминием:
С бромом, представляющим собой тёмно-бурую жидкость, алюминий также реагирует без нагревания. Образец алюминия достаточно просто внести в жидкий бром: тут же начинается бурная реакция с выделением большого количества тепла и света:
Реакция между алюминием и хлором протекает при внесении нагретой алюминиевой фольги или мелкодисперсного порошка алюминия в заполненную хлором колбу. Алюминий эффектно сгорает в хлоре в соответствии с уравнением:
с серой
При нагревании до 150-200 о С или после поджигания смеси порошкообразных алюминия и серы между ними начинается интенсивная экзотермическая реакция с выделением света:
— сульфид алюминия
с азотом
При взаимодействии алюминия с азотом при температуре около 800 o C образуется нитрид алюминия:
с углеродом
При температуре около 2000 o C алюминий взаимодействует с углеродом и образует карбид (метанид) алюминия, содержащий углерод в степени окисления -4, как в метане.
Взаимодействие алюминия со сложными веществами
с водой
Как уже было сказано выше, стойкая и прочная оксидная пленка из Al2O3 не дает алюминию окисляться на воздухе. Эта же защитная оксидная пленка делает алюминий инертным и по отношению к воде. При снятии защитной оксидной пленки с поверхности такими методами, как обработка водными растворами щелочи, хлорида аммония или солей ртути (амальгирование), алюминий начинает энергично реагировать с водой с образованием гидроксида алюминия и газообразного водорода:
с оксидами металлов
После поджигания смеси алюминия с оксидами менее активных металлов (правее алюминия в ряду активности) начинается крайне бурная сильно-экзотермическая реакция. Так, в случае взаимодействия алюминия с оксидом железа (III) развивается температура 2500-3000 о С. В результате этой реакции образуется высокочистое расплавленное железо:
Данный метод получения металлов из их оксидов путем восстановления алюминием называется алюмотермией или алюминотермией.
с кислотами-неокислителями
Взаимодействие алюминия с кислотами-неокислителями, т.е. практически всеми кислотами, кроме концентрированной серной и азотной кислот, приводит к образованию соли алюминия соответствующей кислоты и газообразного водорода:
2Аl 0 + 6Н + = 2Аl 3+ + 3H2 0 ;
с кислотами-окислителями
-концентрированной серной кислотой
Взаимодействие алюминия с концентрированной серной кислотой в обычных условиях, а также низких температурах не происходит вследствие эффекта, называемого пассивацией. При нагревании реакция возможна и приводит к образованию сульфата алюминия, воды и сероводорода, который образуется в результате восстановления серы, входящей в состав серной кислоты:
Читать также: Кованые кашпо на стену
Такое глубокое восстановление серы со степени окисления +6 (в H2SO4) до степени окисления -2 (в H2S) происходит благодаря очень высокой восстановительной способности алюминия.
— концентрированной азотной кислотой
Концентрированная азотная кислота в обычных условиях также пассивирует алюминий, что делает возможным ее хранение в алюминиевых емкостях. Так же, как и в случае с концентрированной серной, взаимодействие алюминия с концентрированной азотной кислотой становится возможным при сильном нагревании, при этом преимущественно протекает реакция:
— разбавленной азотной кислотой
Взаимодействие алюминия с разбавленной по сравнению с концентрированной азотной кислотой приводит к продуктам более глубокого восстановления азота. Вместо NO в зависимости от степени разбавления могут образовываться N2O и NH4NO3:
со щелочами
Алюминий реагирует как с водными растворами щелочей:
так и с чистыми щелочами при сплавлении:
В обоих случаях реакция начинается с растворения защитной пленки оксида алюминия:
В случае водного раствора алюминий, очищенный от защитной оксидной пленки, начинает реагировать с водой по уравнению:
Образующийся гидроксид алюминия, будучи амфотерным, реагирует с водным раствором гидроксида натрия с образованием растворимого тетрагидроксоалюмината натрия:
Алюминий – химически активный металл, но прочная оксидная пленка определяет его стойкость при обычных условиях. Практически во всех химических реакциях алюминий проявляет восстановительные свойства.
- Взаимодействие с неметаллами
С кислородом взаимодействует только в мелкораздробленном состоянии при высокой температуре:
реакция сопровождается большим выделением тепла.
Выше 200°С реагирует с серой с образованием сульфида алюминия:
При 500°С – с фосфором, образуя фосфид алюминия:
При 800°С реагирует с азотом, а при 2000°С – с углеродом, образуя нитрид и карбид:
С хлором и бромом взаимодействует при обычных условиях, а с йодом при нагревании, в присутствии воды в качестве катализатора:
С водородом непосредственно не взаимодействует.
С металлами образует сплавы, которые содержат интерметаллические соединения – алюминиды, например, CuAl2, CrAl7, FeAl3 и др.
Взаимодействие с водой
Очищенный от оксидной пленки алюминий энергично взаимодействует с водой:
в результате реакции образуется малорастворимый гидроксид алюминия и выделяется водород.
Взаимодействие с кислотами
Легко взаимодействует с разбавленными кислотами, образуя соли:
8Al + 30HNO3 = 8Al(NO3)3 + 3N2O + 15H2O (в качестве продукта восстановления азотной кислоты также может быть азот и нитрат аммония).
С концентрированной азотной и серной кислотами при комнатной температуре не взаимодействует, при нагревании реагирует с образованием соли и продукта восстановления кислоты:
Взаимодействие со щелочами
Алюминий – амфотерный металл, он легко реагирует со щелочами:
в растворе с образованием тетрагидроксодиакваалюмината натрия:
при сплавлении с образованием алюминатов:
Восстановление металлов из оксидов и солей
Алюминий – активный металл, способен вытеснять металлы из их оксидов. Это свойство алюминия нашло практическое применение в металлургии:
Одними из самых удобных в обработке материалов являются металлы. Среди них также есть свои лидеры. Так, например, основные свойства алюминия известны людям уже давно. Они настолько подходят для применения в быту, что данный металл стал очень популярным. Каковы же свойства алюминия как простого вещества и как атома, рассмотрим в данной статье.
Страницы
- Главная страница
- ОСНОВЫ ОБЩЕЙ ХИМИИ
- 1.1 Важнейшие классы неорганических веществ
- 2.1 Вещества. Атомы
- 2.2 Размеры атомов
- 2.3 Молекулы. Химические формулы
- 2.4 Простые и сложные вещества
- 2.5 Валентность элементов
- 2.6 Моль. Молярная масса
- 2.7 Закон Авогадро
- 2.8 Закон сохранения массы веществ
- 2.9 Вывод химических формул
- 3.1 Строение атома. Химическая связь
- 3.2 Строение атома
- 3.4 Строение электронной оболочки атома
- 3.5 Периодическая система химических элементов
- 3.6 Зависимость свойств элементов
- 3.7 Химическая связь и строение вещества
- 3.8 Гибридизация орбиталей
- 3.9 Донорно-акцепторный механизм образования
- 3.10 Степени окисления элементов
- 4.1 Классификация химических реакций
- 4.2 Тепловые эффекты реакций
- 4.3 Скорость химических реакций
- 4.4 Необратимые и обратимые реакции
- 4.5 Общая классификация химических реакций
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- 5.1 Растворы. Электролитическая диссоциация
- 5.2 Количественная характеристика состава растворов
- 5.3 Электролитическая диссоциация
- 5.4 Диссоциация кислот, оснований и солей
- 5.5 Диссоциация воды
- 5.6 Реакции обмена в водных растворах электролитов
- 5.7 Гидролиз солей
- 6.1 Важнейшие классы неорганических веществ
- 6.2 Кислоты, их свойства и получение
- 6.3 Амфотерные гидроксиды
- 6.4 Соли, их свойства и получение
- 6.5 Генетическая связь между важнейшими классами
- 6.6 Понятие о двойных солях
- 7.1 Металлы и их соединения
- 7.2 Электролиз
- 7.3 Общая характеристика металлов
- 7.4 Металлы главных подгрупп I и II групп
- 7.5 Алюминий
- 7.6 Железо
- 7.7 Хром
- 7.8 Важнейшие соединения марганца и меди
- 8.1 Неметаллы и их неорганические соединения
- 8.2 Водород, его получение
- 8.3 Галогены. Хлор
- 8.4 Халькогены. Кислород
- 8.5 Сера и ее важнейшие соединения
- 8.6 Азот. Аммиак. Соли аммония
- 8.7 Оксиды азота. Азотная кислота
- 8.8 Фосфор и его соединения
- 8.9 Углерод и его важнейшие соединения
- 8.10 Кремний и его важнейшие соединения
- ОРГАНИЧЕСКАЯ ХИМИЯ
- 9.1 Основные положения органической химии. Углеводороды
- 9.2 Электронные эффекты заместителей в органических соединениях
- 9.3 Предельные углеводороды (алканы)
- 9.3.1 Насыщенные УВ. Метан
- 9.4 Понятие о циклоалканах
- 9.5 Непредельные углеводороды
- 9.6 Диеновые углеводороды (алкадиены)
- 9.7 Алкины
- 9.8 Ароматические углеводороды
- 9.9 Природные источники углеводородов
- 10.1 Кислородсодержащие органические соединения
- 10.2 Фенолы
- 10.3 Альдегиды
- 10.4 Карбоновые кислоты
- 10.5 Сложные эфиры. Жиры
- 10.6 Понятие о поверхностно-активных веществах
- 10.7 Углеводы
- 11.1 Амины. Аминокислоты
- 11.2 Белки
- 11.3 Понятие о гетероциклических соединениях
- 11.4 Нуклеиновые кислоты
- 12.1 Высокомолекулярные соединения
- 12.2 Синтетические волокна
История открытия алюминия
Издавна человеку было известно соединение рассматриваемого металла – алюмокалиевые квасцы. Оно использовалось как средство, способное набухать и связывать между собой компоненты смеси, это было необходимо и при выделке кожаных изделий. О существовании в чистом виде оксида алюминия стало известно в XVIII веке, во второй его половине. Однако при этом чистое вещество получено не было.
Читать также: Фризер для приготовления мягкого мороженого
Сумел же выделить металл из его хлорида впервые ученый Х. К. Эрстед. Именно он обработал амальгамой калия соль и выделил из смеси серый порошок, который и был алюминием в чистом виде.
Тогда же стало понятно, что химические свойства алюминия проявляются в его высокой активности, сильной восстановительной способности. Поэтому долгое время с ним никто больше не работал.
Однако в 1854 году француз Девиль смог получить слитки металла методом электролиза расплава. Этот способ актуален и по сей день. Особенно массовое производство ценного материала началось в XX веке, когда были решены проблемы получения большого количества электроэнергии на предприятиях.
На сегодняшний день данный металл – один из самых популярных и применяемых в строительстве и бытовой промышленности.
Разрушение комплексной соли
Опыт № 3. Взаимодействие раствора тетрагидроксоалюминината натрия с соляной кислотой и углекислым газом
К раствору гидроксоалюмината натрия будем добавлять по каплям разбавленный раствор соляной кислоты. Наблюдаем выпадение осадка гидроксида алюминия и его последующее растворение:
Na[Al(OH)4] + HCl = Al(OH)3¯ + NaCl + H2O
Al(OH)3+ 3HCl = AlCl3 + 3H2O
Тетрагидроксоалюминат натрия неустойчив и в кислой среде разрушается. Посмотрим, разрушает ли комплекс слабая угольная кислота.
Через раствор тетрагидроксоалюмината натрия будем пропускать углекислый газ. Углекислый газ, в свою очередь, получаем по реакции между мрамором и соляной кислотой. Через некоторое время образуется взвесь нерастворимого в воде гидроксида алюминия, которая при дальнейшем пропускании углекислого газа не исчезает.
Na[Al(OH)4] + CO2= Al(OH)3 + NaHCO3
Т. е. избыток углекислоты не растворяет гидроксид алюминия.
Подведение итогов урока
Чтобы получить нерастворимый в воде гидроксид алюминия, надо провести реакцию между раствором соли алюминия и небольшим количеством раствора щелочи (т. к. в избытке щелочи гидроксид алюминия растворяется). Полученный гидроксид алюминия прореагировал и со щелочью, и с кислотой, а значит, он проявил амфотерные свойства. При взаимодействии с раствором щелочи гидроксид алюминия образует комплексную соль, которая разрушается в кислой среде.
Список литературы
- Новошинский И.И., Новошинская Н.С. Химия. Учебник для 10 класса общеобр. учрежд. Профильный уровень. – М.: ООО «ТИД «Русское слово – РС», 2008. (§ 54)
- Кузнецова Н.Е., Литвинова Т.Н., Лёвкин А.Н. Химия: 11 класс: Учебник для учащихся общеобраз. учрежд. (профильный уровень): в 2-х ч. Ч.2. М.: Вентана-Граф, 2008. (с. 110–111)
- Радецкий А.М. Химия. Дидактический материал. 10–11 классы. – М.: Просвещение, 2011.
- Хомченко И.Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Алхимик (Источник).
- Алхимик (Источник).
- Chemport (Источник).
- Lidijavk.ucoz.ru (Источник).
Домашнее задание
- с. 27-29 №№ 5.1, 5.15, 5.25 из сборника задач и упражнений по химии для средней школы (Хомченко И.Д.), 2008.
- Запишите уравнение реакции, в результате которой образуется гидроксид хрома (III); проиллюстрируйте уравнениями реакций амфотерный характер данного гидроксида.
Общая характеристика атома алюминия
Если характеризовать рассматриваемый элемент по положению в периодической системе, то можно выделить несколько пунктов.
- Порядковый номер – 13.
- Располагается в третьем малом периоде, третьей группе, главной подгруппе.
- Атомная масса – 26,98.
- Количество валентных электронов – 3.
- Конфигурация внешнего слоя выражается формулой 3s 2 3p 1 .
- Название элемента – алюминий.
- Металлические свойства выражены сильно.
- Изотопов в природе не имеет, существует только в одном виде, с массовым числом 27.
- Химический символ – AL, в формулах читается как «алюминий».
- Степень окисления одна, равна +3.
Химические свойства алюминия полностью подтверждаются электронным строением его атома, ведь имея большой атомный радиус и малое сродство к электрону, он способен выступать в роли сильного восстановителя, как и все активные металлы.
Алюминий как простое вещество: физические свойства
Если говорить об алюминии, как о простом веществе, то он представляет собой серебристо-белый блестящий металл. На воздухе быстро окисляется и покрывается плотной оксидной пленкой. Тоже самое происходит и при действии концентрированных кислот.
Наличие подобной особенности делает изделия из этого металла устойчивыми к коррозии, что, естественно, очень удобно для людей. Поэтому и находит такое широкое применение в строительстве именно алюминий. Свойства вещества также еще интересны тем, что данный металл очень легкий, при этом прочный и мягкий. Сочетание таких характеристик доступно далеко не каждому веществу.
Можно выделить несколько основных физических свойств, которые характерны для алюминия.
- Высокая степень ковкости и пластичности. Из данного металла изготовляют легкую, прочную и очень тонкую фольгу, его же прокатывают в проволоку.
- Температура плавления – 660 0 С.
- Температура кипения – 2450 0 С.
- Плотность – 2,7 г/см 3 .
- Кристаллическая решетка объемная гранецентрированная, металлическая.
- Тип связи – металлическая.
Физические и химические свойства алюминия определяют области его применения и использования. Если говорить о бытовых сторонах, то большую роль играют именно уже рассмотренные нами выше характеристики. Как легкий, прочный и антикоррозионный металл, алюминий применяется в самолето- и кораблестроении. Поэтому эти свойства очень важно знать.
Химические свойства алюминия
С точки зрения химии, рассматриваемый металл – сильный восстановитель, который способен проявлять высокую химическую активность, будучи чистым веществом. Главное – это устранить оксидную пленку. В этом случае активность резко возрастает.
Химические свойства алюминия как простого вещества определяются его способностью вступать в реакции с:
С водой он не взаимодействует при обычных условиях. При этом из галогенов без нагревания реагирует только с йодом. Для остальных реакций нужна температура.
Можно привести примеры, иллюстрирующие химические свойства алюминия. Уравнения реакций взаимодействия с:
- кислотами – AL + HCL = AlCL3 + H2;
- щелочами – 2Al + 6H2O + 2NaOH = Na[Al(OH)4] + 3Н2;
- галогенами – AL + Hal = ALHal3;
- серой – 2AL + 3S = AL2S3.
Читать также: Фреза шипорезная для ручного фрезера
В целом, самое главное свойство рассматриваемого вещества – это высокая способность к восстановлению других элементов из их соединений.
Химические свойства комплексных солей (на примере соединений алюминия и цинка)
В рамках программы ЕГЭ по химии следует усвоить химические свойства таких комплексных соединений алюминия и цинка, как тетрагидроксоалюминаты и третрагидроксоцинкаты.
Тетрагидроксоалюминатами и тетрагидроксоцинкатами называют соли, анионы которых имеют формулы [Al(OH)4]— и [Zn(OH)4]2- соответственно. Рассмотрим химические свойства таких соединений на примере солей натрия:
Данные соединения, как и другие растворимые комплексные, хорошо диссоциируют, при этом практически все комплексные ионы (в квадратных скобках) остаются целыми и не диссоциируют дальше:
Действие избытка сильной кислоты на данные соединения приводит к образованию двух солей:
При действии же на них недостатка сильных кислот в новую соль переходит только активный металл. Алюминий и цинк в составе гидроксидов выпадают в осадок:
Осаждение гидроксидов алюминия и цинка сильными кислотами не является удачным выбором, поскольку сложно добавить строго необходимое для этого количество сильной кислоты, не растворив при этом часть осадка. По этой причине для этого используют углекислый газ, обладающий очень слабыми кислотными свойствами и благодаря этому не способный растворить осадок гидроксида:
В случае тетрагидроксоалюмината осаждение гидроксида также можно проводить, используя диоксид серы и сероводород:
В случае тетрагидроксоцинката осаждение сероводородом невозможно, поскольку в осадок вместо гидроксида цинка выпадает его сульфид:
При упаривании растворов тетрагидроксоцинката и тетрагидроксоалюмината с последующим прокаливанием данные соединения переходят соответственно в цинкат и алюминат:
Распространение в природе
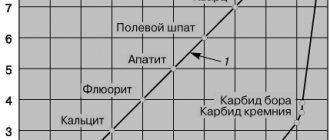
По распространенности среди других элементов-металлов алюминий занимает первое место. Его в земной коре содержится 8,8 %. Если же сравнивать с неметаллами, то место его будет третьим, после кислорода и кремния.
Вследствие высокой химической активности он не встречается в чистом виде, а лишь в составе различных соединений. Так, например, известно множество руд, минералов, горных пород, в состав которых входит алюминий. Однако добывается он только из бокситов, содержание которых в природе не слишком велико.
Самые распространенные вещества, содержащие рассматриваемый металл:
- полевые шпаты;
- бокситы;
- граниты;
- кремнезем;
- алюмосиликаты;
- базальты и прочие.
В небольшом количестве алюминий обязательно входит в состав клеток живых организмов. Некоторые виды плаунов и морских обитателей способны накапливать этот элемент внутри своего организма в течение жизни.
Получение
Физические и химические свойства алюминия позволяют получать его только одним способом: электролизом расплава соответствующего оксида. Однако процесс этот технологически сложен. Температура плавления AL2O3 превышает 2000 0 С. Из-за этого подвергать электролизу непосредственно его не получается. Поэтому поступают следующим образом.
- Добывают бокситы.
- Очищают их от примесей, оставляя лишь оксид алюминия.
- Затем плавят криолит.
- Добавляют туда оксид.
- Данную смесь элекролизуют и получают чистый алюминий и углекислый газ.
Выход продукта составляет 99,7 %. Однако возможно получение и еще более чистого металла, который используется в технических целях.
Получение и применение алюминия
Алюминий достаточно трудно выделить из природных соединений химическим способом, что объясняется высокой прочностью связей в оксиде алюминия, поэтому, для промышленного получения алюминия применяют электролиз раствора глинозема Al2O3 в расплавленном криолите Na3AlF6. В результате процесса алюминий выделяется на катоде, на аноде — кислород:
2Al2O3 → 4Al + 3O2
Исходным сырьем служат бокситы. Электролиз протекает при температуре 1000°C: температура плавления оксида алюминия составляет 2500°C — проводить электролиз при такой температуре не представляется возможным, поэтому оксид алюминия растворяют в расплавленном криолите, и уже затем полученный электролит используют при электролизе для получения алюминия.
Применение алюминия:
- алюминиевые сплавы широко применяются в качестве конструкционных материалов в автомобиле-, самолето-, судостроении: дюралюминий, силумин, алюминиевая бронза;
- в химической промышленности в качестве восстановителя;
- в пищевой промышленности для изготовления фольги, посуды, упаковочного материала;
- для изготовления проводов и проч.
В начало страницы
Применение
Механические свойства алюминия не столь хороши, чтобы применять его в чистом виде. Поэтому чаще всего используются сплавы на основе данного вещества. Таких много, можно назвать самые основные.
- Дюралюминий.
- Алюминиево-марганцевые.
- Алюминиево-магниевые.
- Алюминиево-медные.
- Силумины.
- Авиаль.
Основное их отличие – это, естественно, сторонние добавки. Во всех основу составляет именно алюминий. Другие же металлы делают материал более прочным, стойким к коррозии, износоустойчивым и податливым в обработке.
Можно назвать несколько основных областей применения алюминия как в чистом виде, так и в виде его соединений (сплавов).
- Для изготовления проволоки и фольги, используемой в быту.
- Изготовление посуды.
- Самолетостроение.
- Кораблестроение.
- Строительство и архитектура.
- Космическая промышленность.
- Создание реакторов.
Вместе с железом и его сплавами алюминий – самый важный металл. Именно эти два представителя периодической системы нашли самое обширное промышленное применение в руках человека.
Свойства гидроксида алюминия
Гидроксид – самое распространенное соединение, которое образует алюминий. Свойства химические его такие же, как и у самого металла, – он амфотерный. Это значит, что он способен проявлять двойственную природу, вступая в реакции как с кислотами, так и со щелочами.
Сам по себе гидроксид алюминия – это белый студенистый осадок. Получить его легко при взаимодействии соли алюминия с щелочью или гидроксидом аммония. При взаимодействии с кислотами данный гидроксид дает обычную соответствующую соль и воду. Если же реакция идет с щелочью, то формируются гидроксокомплексы алюминия, в которых его координационное число равно 4. Пример: Na[Al(OH)4] – тетрагидроксоалюминат натрия.
Номенклатура
Присвоения имен для различных форм гидроксида алюминия является неоднозначным и не существует никакого универсального стандарта. Все четыре полиморфных имеют химический состав тригидроксида алюминия (один алюминиевый атом , прикрепленный к трем гидроксидным группам).
Гиббсит также известен как гидраргиллит, названный в честь греческих слов для воды ( гидры
) и глины (
argylles
). Первое соединение назвали
гидраргиллит
считалось, что гидроксид алюминия, но позднее было обнаружено, что фосфат алюминия ; несмотря на это, как
гиббсит
и
гидраргиллит
используются для обозначения того же полиморфизм гидроксида алюминия, с
гиббситом
используется наиболее часто в Соединенных Штатах и
гидраргиллит
чаще используется в Европе. В 1930 г. он был передан в качестве
тригидрат α-оксида алюминия
, чтобы противопоставить его с байерита , который получил название
тригидрат β-оксида алюминия
(альфа и бета обозначения были использованы , чтобы дифференцировать более и менее распространенные формы соответственно). В 1957 год симпозиум по глиноземной номенклатуре попытался разработать универсальный стандарт, в результате чего гиббсита быть обозначен & gamma; Al (OH) 3 , байерит став альфа-Al (OH) 3 , и нордстрандит быть обозначен Al (OH) 3 . На основе их кристаллографических свойств, предложенный номенклатура и обозначение для гиббсита , чтобы быть α-Al (OH) 3 , байерит , которые будут назначены бета-Al (OH) 3 , и оба нордстрандит и doyleite обозначены Al (OH) 3 . В соответствии с этим назначением, альфа и бета префиксы относятся к гексагональным, плотно упакованным структурам и измененным или обезвоженным полиморфизмам , соответственно, без дифференциации между нордстрандят и doyleite.