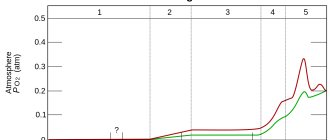
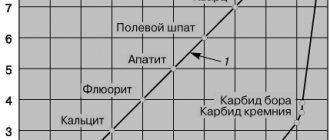
Историческая справка.
Первые сведения о кислороде стали известны в Европе из китайских рукописей 8 в. В начале 16 в. Леонардо да Винчи опубликовал данные, связанные с химией кислорода, не зная еще, что кислород – элемент. Реакции присоединения кислорода описаны в научных трудах С.Гейлса (1731) и П.Байена (1774). Заслуживают особого внимания исследования К.Шееле в 1771–1773 взаимодействия металлов и фосфора с кислородом. Дж.Пристли сообщил об открытии кислорода как элемента в 1774, спустя несколько месяцев после сообщения Байена о реакциях с воздухом. Название oxygenium («кислород») дано этому элементу вскоре после его открытия Пристли и происходит от греческих слов, обозначающих «рождающий кислоту»; это связано с ошибочным представлением о том, что кислород присутствует во всех кислотах. Объяснение роли кислорода в процессах дыхания и горения, однако, принадлежит А.Лавуазье (1777).
История открытия
Официально считается, что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).
2HgO →ot 2Hg + O2↑
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье. В 1775 году А. Лавуазье установил, что кислород является составной частью воздуха, кислот и содержится во многих веществах.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Пьера Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория. Лавуазье провёл опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожжённых элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Строение атома.
Также по теме:
ВОЗДУХ
Любой природный атом кислорода содержит 8 протонов в ядре, но число нейтронов может быть равно 8, 9 или 10. Наиболее распространенный из трех изотопов кислорода (99,76%) – это 168O (8 протонов и 8 нейтронов). Содержание другого изотопа, 188O (8 протонов и 10 нейтронов), составляет всего 0,2%. Этот изотоп используется как метка или для идентификации некоторых молекул, а также для проведения биохимических и медико-химических исследований (метод изучения нерадиоактивных следов). Третий нерадиоактивный изотоп кислорода 178O (0,04%) содержит 9 нейтронов и имеет массовое число 17. После того как в 1961 масса изотопа углерода 126C была принята Международной комиссией за стандартную атомную массу, средневзвешенная атомная масса кислорода стала равна 15,9994. До 1961 стандартной единицей атомной массы химики считали атомную массу кислорода, принятую для смеси трех природных изотопов кислорода равной 16,000. Физики за стандартную единицу атомной массы принимали массовое число изотопа кислорода 168O, поэтому по физической шкале средняя атомная масса кислорода составляла 16,0044 (см. также
АТОМНАЯ МАССА).
В атоме кислорода 8 электронов, при этом 2 электрона находятся на внутреннем уровне, а 6 электронов – на внешнем. Поэтому в химических реакциях кислород может принимать от доноров до двух электронов, достраивая свою внешнюю оболочку до 8 электронов и образуя избыточный отрицательный заряд (см. также
АТОМА СТРОЕНИЕ).
Молекулярный кислород.
Как большинство других элементов, у атомов которых для достройки внешней оболочки из 8 электронов не хватает 1–2 электронов, кислород образует двухатомную молекулу. В этом процессе выделяется много энергии (~490 кДж/моль) и соответственно столько же энергии необходимо затратить для обратного процесса диссоциации молекулы на атомы. Прочность связи O–O настолько высока, что при 2300° С только 1% молекул кислорода диссоциирует на атомы. (Примечательно, что при образовании молекулы азота N2 прочность связи N–N еще выше, ~710 кДж/моль.)
Реакции.
В соответствующих условиях молекулярный кислород реагирует практически с любым элементом, кроме благородных газов. Однако при комнатных условиях только наиболее активные элементы реагируют с кислородом достаточно быстро. Вероятно, большинство реакций протекает только после диссоциации кислорода на атомы, а диссоциация происходит лишь при очень высоких температурах. Однако катализаторы или другие вещества в реагирующей системе могут способствовать диссоциации O2. Известно, что щелочные (Li, Na, K) и щелочноземельные (Ca, Sr, Ba) металлы реагируют с молекулярным кислородом с образованием пероксидов:
Химические свойства
Сильный окислитель, самый активный неметалл после фтора, образует бинарные соединения (оксиды
) со всеми элементами, кроме гелия, неона, аргона. Наиболее распространенная степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры (см. Горение). Пример реакций, протекающих при комнатной температуре:
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
2NO+O2→2NO2↑{\displaystyle {\mathsf {2NO+O_{2}\rightarrow 2NO_{2}\uparrow }}}
Окисляет большинство органических соединений в реакциях горения:
2C6H6+15O2→12CO2+6H2O{\displaystyle {\mathsf {2C_{6}H_{6}+15O_{2}\rightarrow 12CO_{2}+6H_{2}O}}} CH3CH2OH+3O2→2CO2+3H2O{\displaystyle {\mathsf {CH_{3}CH_{2}OH+3O_{2}\rightarrow 2CO_{2}+3H_{2}O}}}
При определённых условиях можно провести мягкое окисление органического соединения:
CH3CH2OH+O2→CH3COOH+H2O{\displaystyle {\mathsf {CH_{3}CH_{2}OH+O_{2}\rightarrow CH_{3}COOH+H_{2}O}}}
Кислород реагирует непосредственно (при нормальных условиях, при нагревании и/или в присутствии катализаторов) со всеми простыми веществами, кроме Au и инертных газов (He, Ne, Ar, Kr, Xe, Rn); реакции с галогенами происходят под воздействием электрического разряда или ультрафиолета. Косвенным путём получены оксиды золота и тяжёлых инертных газов (Xe, Rn). Во всех двухэлементных соединениях кислорода с другими элементами кислород играет роль окислителя, кроме соединений со фтором (см. ниже ).
Кислород образует пероксиды
со степенью окисления атома кислорода, формально равной −1.
Например, пероксиды получаются при сгорании щелочных металлов в кислороде:
2Na+O2→Na2O2{\displaystyle {\mathsf {2Na+O_{2}\rightarrow Na_{2}O_{2}}}}
Некоторые оксиды поглощают кислород:
2BaO+O2→2BaO2{\displaystyle {\mathsf {2BaO+O_{2}\rightarrow 2BaO_{2}}}}
По теории горения, разработанной А. Н. Бахом и К. О. Энглером, окисление происходит в две стадии с образованием промежуточного пероксидного соединения. Это промежуточное соединение можно выделить, например, при охлаждении пламени горящего водорода льдом, наряду с водой, образуется пероксид водорода:
H2+O2→H2O2{\displaystyle {\mathsf {H_{2}+O_{2}\rightarrow H_{2}O_{2}}}}
В надпероксидах кислород формально имеет степень окисления −½, то есть один электрон на два атома кислорода (ион O−2). Получают взаимодействием пероксидов с кислородом при повышенных давлении и температуре:
Na2O2+O2→2NaO2{\displaystyle {\mathsf {Na_{2}O_{2}+O_{2}\rightarrow 2NaO_{2}}}}
Калий K, рубидий Rb и цезий Cs реагируют с кислородом с образованием надпероксидов:
K+O2→KO2{\displaystyle {\mathsf {K+O_{2}\rightarrow KO_{2}}}}
Неорганические озониды содержат ион O−3 со степенью окисления кислорода, формально равной −1/3. Получают действием озона на гидроксиды щелочных металлов:
3KOH+3O3→2KO3+KOH∗H2O+2O2↑{\displaystyle {\mathsf {3KOH+3O_{3}\rightarrow 2KO_{3}+KOH*H_{2}O+2O_{2}\uparrow }}}
В ионе диоксигенила O2+ кислород имеет формально степень окисления +½. Получают по реакции:
PtF6+O2→O2PtF6{\displaystyle {\mathsf {PtF_{6}+O_{2}\rightarrow O_{2}PtF_{6}}}}
В этой реакции, кислород проявляет восстановительные свойства.
Фториды кислорода
Дифторид кислорода, OF2 степень окисления кислорода +2, получают пропусканием фтора через разбавленный раствор щелочи:
2F2+2NaOH→2NaF+H2O+OF2↑{\displaystyle {\mathsf {2F_{2}+2NaOH\rightarrow 2NaF+H_{2}O+OF_{2}\uparrow }}}
Монофторид кислорода (Диоксидифторид), O2F2, нестабилен, степень окисления кислорода +1. Получают из смеси фтора с кислородом в тлеющем разряде при температуре −196 °C:
F2+O2→O2F2{\displaystyle {\mathsf {F_{2}+O_{2}\rightarrow O_{2}F_{2}}}}
Пропуская тлеющий разряд через смесь фтора с кислородом при определённых давлении и температуре, получают смеси высших фторидов кислорода O3F2, O4F2, O5F2 и O6F2.
Квантовомеханические расчёты предсказывают устойчивое существование иона трифторгидроксония (англ.) OF3+. Если этот ион действительно существует, то степень окисления кислорода в нём будет равна +4.
Кислород поддерживает процессы дыхания, горения, гниения.
В свободном виде элемент существует в двух аллотропных модификациях: O2 и O3 (озон). Как установили в 1899 году Пьер Кюри и Мария Склодовская-Кюри, под воздействием ионизирующего излучения O2 переходит в O3.
Получение и применение.
Благодаря наличию свободного кислорода в атмосфере наиболее эффективным методом его извлечения является сжижение воздуха, из которого удаляют примеси, CO2, пыль и т.д. химическими и физическими методами. Циклический процесс включает сжатие, охлаждение и расширение, что и приводит к сжижению воздуха. При медленном подъеме температуры (метод фракционной дистилляции) из жидкого воздуха испаряются сначала благородные газы (наиболее трудно сжижаемые), затем азот и остается жидкий кислород. В результате жидкий кислород содержит следы благородных газов и относительно большой процент азота. Для многих областей применения эти примеси не мешают. Однако для получения кислорода особой чистоты процесс дистилляции необходимо повторять. Кислород хранят в танках и баллонах. Он используется в больших количествах как окислитель керосина и других горючих в ракетах и космических аппаратах. Сталелитейная промышленность потребляет газообразный кислород для продувки через расплав чугуна по методу Бессемера для быстрого и эффективного удаления примесей C, S и P. Сталь при кислородном дутье получается быстрее и качественнее, чем при воздушном. Кислород используется также для сварки и резки металлов (кислородно-ацетиленовое пламя). Применяют кислород и в медицине, например, для обогащения дыхательной среды пациентов с затрудненном дыханием. Кислород можно получать различными химическими методами, и некоторые из них применяют для получения малых количеств чистого кислорода в лабораторной практике.
Как получают жидкий кислород?
Кислород, которым мы дышим, – это своеобразный «микс» из азота, кислорода и аргона. Смесь также содержит углекислый газ (0,03%), водород, закись азота и другие редкие газы. Для того чтобы перевести кислород в жидкое состояние, необходимо охладить воздух. При давлении в 50 атмосфер и температуре воздуха от -191,8 до -193,7 достигается глубокое охлаждение воздуха и его переход в жидкое состояние.
После этого проводят ректификацию, то есть отделение азота от кислорода. Этого добиваются путем многократного нагревания жидкости, в ходе которого первым делом испаряется азот, а оставшаяся жидкость обогащается О2.
Термическая диссоциация.
Важный лабораторный метод получения кислорода, предложенный Дж.Пристли, заключается в термическом разложении оксидов тяжелых металлов: 2HgO ® 2Hg + O2. Пристли для этого фокусировал солнечные лучи на порошок оксида ртути. Известным лабораторным методом является также термическая диссоциация оксосолей, например хлората калия в присутствии катализатора – диоксида марганца:
Диоксид марганца, добавляемый в небольших количествах перед прокаливанием, позволяет поддерживать требуемую температуру и скорость диссоциации, причем сам MnO2 в процессе не изменяется.
Используются также способы термического разложения нитратов:
а также пероксидов некоторых активных металлов, например:
2BaO2® 2BaO + O2
Последний способ одно время широко использовался для извлечения кислорода из атмосферы и заключался в нагревании BaO на воздухе до образования BaO2 с последующим термическим разложением пероксида. Способ термического разложения сохраняет свое значение для получения пероксида водорода.
НЕКОТОРЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА
| НЕКОТОРЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА | |
| Атомный номер | 8 |
| Атомная масса | 15,9994 |
| Температура плавления, °С | –218,4 |
| Температура кипения, °С | –183,0 |
| Плотность | |
| твердый, г/см3 (при t пл) | 1,27 |
| жидкий г/см3 (при t кип) | 1,14 |
| газообразный, г/дм3 (при 0° С) | 1,429 |
| относительная по воздуху | 1,105 |
| критическаяа, г/см3 | 0,430 |
| Критическая температураа, °С | –118,8 |
| Критическое давлениеа, атм | 49,7 |
| Растворимость, см3/100 мл растворителя | |
| в воде (0° С) | 4,89 |
| в воде (100° С) | 1,7 |
| в спирте (25° С) | 2,78 |
| Радиус, Å | 0,74 |
| ковалентный | 0,66 |
| ионный (О2–) | 1,40 |
| Потенциал ионизации, В | |
| первый | 13,614 |
| второй | 35,146 |
| Электроотрицательность (F = 4) | 3,5 |
| а Температура и давление, при которых плотность газа и жидкости одинаковы. | |
[править] Литература
- Глоссарий терминов по химии // Й.Опейда, О.Швайка. Ин-т физико-органической химии и углехимии им. Л. М. Литвиненко НАН Украины, Донецкий национальный университет — Донецк: «Вебер», 2008. — 758 с. ISBN 978-966-335-206-0
- Ф. А. Деркач «Химия» Л. 1968
- Малая горная энциклопедия . В 3-х т. / Под ред. В. С. Белецкого . — Донецк: Донбасс, 2004. — ISBN 966-7804-14-3 .
- Михаличко Б. М. Курс общей химии. Теоретические основы: Учебное пособие. — М .: Знание, 2009. — 548 с. ISBN 978-966-346-712-2
- Кириченко В. И. Общая химия: Учебное пособие. — К .: Высшая школа, 2005. — 639 с . — (ил.) ISBN 966-642-182-8
| Периодическая система химических элементов Д. И. Менделеева | |||||||||||||||||||||||||||||||
| H | He | ||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | ||||||||||||||||||||||||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Суперактиноиды | Переходные металлы | Другие металлы | Полуметаллы | Другие неметаллы | Галогены | Благородные газы | Свойства неизвестны |
Пероксид водорода.
Другим соединением, состоящим только из водорода и кислорода, является пероксид водорода H2O2. Название «пероксид» принято для соединений, содержащих связь –O–O–. Пероксид водорода имеет строение асимметрично изогнутой цепи:
Пероксид водорода получают по реакции пероксида металла с кислотой
BaO2 + H2SO4® BaSO4 + H2O2
либо разложением пероксодисерной кислоты H2S2O8, которую получают электролитически:
Концентрированный раствор H2O2 может быть получен специальными методами дистилляции. Пероксид водорода используют как окислитель в двигателях ракет. Разбавленные растворы пероксида служат антисептиками, отбеливателями и мягкими окислителями. H2O2 добавляют ко многим кислотам и оксидам для получения соединений, аналогичных гидратам. В присутствии сильного окислителя (например, MnO2 или MnO4–) H2O2 окисляется, выделяя кислород и воду.
Оксоанионы и оксокатионы
– кислородсодержащие частицы, имеющие остаточный отрицательный (оксоанионы) или остаточный положительный (оксокатионы) заряд. Ион O2– имеет высокое сродство (высокую реакционную способность) к положительно заряженным частицам типа H+. Простейшим представителем стабильных оксоанионов является гидроксид-ион OH–. Это объясняет неустойчивость атомов с высокой зарядовой плотностью и их частичную стабилизацию в результате присоединения частицы с положительным зарядом. Поэтому при действии активного металла (или его оксида) на воду образуется OH–, а не O2–:
2Na + 2H2O ® 2Na+ + 2OH– + H2
или
Na2O + H2O ® 2Na+ + 2OH–
Более сложные оксоанионы образуются из кислорода с ионом металла или неметаллической частицей, имеющей большой положительный заряд, в результате получается низкозаряженная частица, обладающая большей стабильностью, например:
Симптомы у человека при недостатке кислорода в воздухе
Нормальное содержание O2 в воздухе находится в пределах 21%. При понижении его количества в результате сгорания или вымещения инертными газами (аргон, гелий) возникает недостаток кислорода, последствия, и симптомы которого указаны в таблице ниже.
| Содержание O2 (% по объему) | Последствия и симптомы (при атмосферном давлении) |
| 15-19% | Снижение работоспособности. Может произойти нарушение координации. Первые симптомы могут проявиться у людей с нарушением коронарного кровообращения, общего кровообращения или работы легких |
| 12-14% | Затруднение дыхания, учащение пульса, нарушение координации и восприятия. |
| 10-12% | Еще более глубокое и учащенное дыхание, потеря здравомыслия, посинение губ. При нахождении в атмосфере, содержащем 12% и менее O2, потеря сознания происходит внезапно и так быстро, что у человека не остается времени на то, чтобы предпринять какие-то меры. |
| 8-10% | Нарушение мыслительной деятельности, обморок, потеря сознания, мертвенно-бледное лицо, синие губы, рвота. |
| 6-8% | 8 мин — 100% летальный исход; 6 мин — 50%; 4-5 мин — возможно спасение жизни с медицинской помощью. |
| 4-6%. | Через 40 секунд — кома, конвульсии, прекращение дыхания, смерть от нехватки кислорода. |
При наличии вышеуказанных симптомов пострадавшего следует быстро вынести на свежий воздух и дать ему подышать кислородом или сделать искусственное дыхание. Необходима немедленная медицинская помощь.
Ингаляция насыщенного кислородом воздуха должна проводиться под наблюдением врача.
Озон.
Кроме атомарного кислорода O и двухатомной молекулы O2 существует третья форма кислорода – озон O3, содержащий три кислородных атома. Все три формы являются аллотропными модификациями. Озон образуется при пропускании тихого электрического разряда через сухой кислород: 3O2 2O3.
При этом образуется несколько процентов озона. Реакция катализируется ионами металлов. Озон имеет острый резкий запах, который можно обнаружить вблизи работающих электрических машин или в окрестности атмосферного электрического разряда. Газ имеет голубоватый цвет и конденсируется при –112° С в темноголубую жидкость, а при –193° С образуется темнопурпуровая твердая фаза. Жидкий озон слаборастворим в жидком кислороде, а в 100 г воды при 0° С растворяется 49 см3 O3. По химическим свойствам озон намного активнее кислорода и по окислительным свойствам уступает только O, F2 и OF2 (дифториду кислорода). При обычном окислении образуются оксид и молекулярный кислород O2. При действии озона на активные металлы в особых условиях образуются озониды состава K+O3–. Озон получают в промышленности для специальных целей, он является хорошим дезинфицирующим средством и используется для очистки воды и как отбеливатель, улучшает состояние атмосферы в закрытых системах, дезинфицирует предметы и пищу, ускоряет созревание зерна и фруктов. В химической лаборатории часто используют озонатор для получения озона, необходимого для некоторых методов химического анализа и синтеза. Каучук легко разрушается даже под действием малых концентраций озона. В некоторых промышленных городах значительная концентрация озона в воздухе приводит к быстрой порче резиновых изделий, если они не защищены антиоксидантами. Озон очень токсичен. Постоянное вдыхание воздуха даже с очень низкими концентрациями озона вызывает головную боль, тошноту и другие неприятные состояния.
В каких областях используют жидкий кислород?
В настоящее время жидкому кислороду находится применение в разных областях промышленности:
- химической,
- стекольной,
- металлургической,
- фармацевтической,
- целлюлозно-бумажной.
Жидкий О2 служит в качестве сырья для получения других химических соединений, вроде двуокиси титана или окиси этилена. С его помощью также можно повысить производительность большинства окислительных процессов.
В стекольной промышленности кислород применяется для интенсификации процессов горения, необходимых для поддержания работы стеклоплавильных печей. Помимо этого, он помогает снизить выбросы оксида азота и увеличить эффективность стекольного производства.
С этой же целью жидкий О2 используется в металлургии, где он обогащает воздух и повышает эффективность процесса горения.
С жидким кислородом связано ускорение процессов роста клеток, поэтому в фармацевтике его добавляют в ферментеры и биореакторы.
В целлюлозно-бумажной отрасли промышленности с помощью этого вида кислорода осуществляется окислительное экстрагирование, обработка сточных вод и делигнификация (процесс получения целлюлозы).
Помимо этого, кислородом жидким пользуются в автомобилестроении и машиностроении, где он применяется в качестве вспомогательного газа во время лазерной резки. Его также добавляют в состав защитных газовых смесей.