Цинк или Zincum является 30 элементом периодической системы химических элементов Менделеева и обозначается символом Zn . В основном он используется при создании деформированных полуфабрикатов и в составе разного рода смесей. В чистом виде выглядит как хрупкий металл голубовато-серебристого цвета, быстро окисляется и покрывается защитной пленкой (оксидом), из-за которой заметно тускнеет.
Добывают его в Казахстане, Австралии, Иране и Боливии. Из-за сложностей в определении металла его часто называют «обманкой».
Историческая справка
Само название «цинк» впервые было упомянуто в книге « Liber Mineralium » Парацельса. По некоторым данным оно означало «зубец». Сплав цинка с медью или латунь известен давно. Его применяли в Древней Греции, Индии и Древнем Египте, позднее материал стал известен в Китае.
В чистом виде металл удалось получить лишь в первой половине XVIII века в 1738 году в Великобритании при помощи дистилляционного способа. Его открывателем стал Уильям Чемпион. Промышленное производство началось через 5 лет, а в 1746 году в Германии химик Андреас Сигизмунд Маргграф разработал и в деталях описал собственный способ получения цинка. Он предлагал использовать метод прокаливания смеси окиси металл с углем в огнеупорных ретортах из глины без доступа воздуха. Последующая конденсация паров должна была проходить в холодильнике. Из-за подробного описания и кропотливых разработок Маргграфа часто называют первооткрывателем вещества.
В начале XIX века был найден способ выделения металла путем прокатки при 100 C о-150 C о. В начале следующего века научились добывать цинк электролитическим способом. В России первый металл получили только в 1905 году.
Физические свойства
- Атомный номер: 30.
- Атомная масса: 65,37.
- Атомный объем: 9,15
- Плотность: 7,133 г/см3.
- Температура, необходимая для плавления: 419,5 C о.
- Температура кипения: 906 C о.
- Поверхностная энергия: 105 мДж/м2.
- Удельная электропроводность: 16,2*10-6 См/м.
- Молярная теплоемкость: 25,4 Дж/(К*моль).
- Молярный объем: 9,2 см3/моль.
Цинк обладает слабыми механическими свойствами, при нормальной температуре легко ломается и крошится, но при температуре 100 C о-150 C о становится довольно тягучим и легко поддается деформации: куется, раскатывается в листы. Простая вода для металла безопасна, а кислоты и щелочи легко разъедают. Из-за этого цинк в чистом виде для изготовления деталей не применяют, только сплавы.
Свойства цинка
Цинк находится во второй группе периодической системы. Подобно другим элементам этой группы, он двухвалентен и имеет явно выраженные металлические свойства. Но как металл цинк уступает в активности бериллию, магнию и щелочноземельным металлам, представляющим главную подгруппу той же второй группы.
Порядковый номер цинка 30, в четвертом ряду он находится на рубеже между никелем и медью – с одной стороны и галлием, германием и мышьяком – с другой. Такое переходное положение между типичными металлами и неметаллами объясняет появление у цинка неметаллических свойств, выраженных в амфотерности его окиси.
Точки плавления и кипения цинка соответственно равны 427 и 907 ºС. Сравнительно низкая температура кипения была причиной, задержавшей развитие производства цинка. Привычные способы выплавки металлов нагреванием смеси руды и угля не давали результата из-за летучести цинка, который уходил из печного пространства с дымовыми газами в виде паров. Позднее научились конденсировать пары, что породило дистилляционный способ получения цинка.
Природный цинк с атомной массой 65,37 состоит из пяти изотопов: Zn64, Zn66, Zn67, Zn68, Zn70 .
Электрохимический потенциал цинка
Zn2+ + 2e = Zn; E0 = -0,76 в.
Большая отрицательная величина потенциала характеризует высокую активность цинка. Однако он разлагает холодную воду; причина тому не только покрывающая металл тонкая пленка основных углекислых солей, но и медленный разряд ионов водорода на цинке – высокое перенапряжение на нем водорода.
Примеси железа, меди и других более электроположительных металлов значительно ускоряют растворение цинка в кислотах.
Для защиты железа от коррозии его покрывают слоем цинка. При местном разрушении покрытия защита продолжается: обнаженные участки железа не разрушаются, они становятся местами выделения водорода за счет растворения цинка.
В сильных кислотах цинк растворяется с выделением водорода, а в растворах щелочей – с образованием анионов цинковой кислоты, цинкатов:
Zn + 2NaOH = Na2ZnO2 + H2.
Окись цинка ZnO – рыхлый белый порошок, получаемый сжиганием паров цинка на воздухе, ее широко применяют для производства масляных и других малярных красок: чистый белый цвет и кроющая способность сделали цинковые белила необходимым материалом в малярном деле.
Окись цинка – вещество неплавкое: при температурах выше 1800 ºС она испаряется без плавления. Температура начала восстановления цинка из окиси углеродом около 950 ºС.
Сульфид цинка ZnS также неплавок и при температуре выше 1180 ºС заметно летуч. При нагревании на воздухе ZnS окисляется до основных сульфатов – ZnO · nZnSO4, сульфата ZnSO4 и окиси ZnO.
Химические свойства
Внешняя электронная конфигурация одного атома цинка можно записать как 3 d 104 s 2. Металл активен и является энергичным восстановителем. При температуре в 100 C она открытом воздухе покрывается пленкой, состоящей из основных карбонатов, и сильно тускнеет. При воздействии углекислого газа и повышенной влажности элемент начинает разрушаться. В кислородной или обычной среде при сильном нагревании цинк сгорает, образуя голубоватое пламя и белый дым, который состоит из оксида цинка. Огнеопасно воздействуют на цинк сухие элементы фтора, брома и хлора, но только при участии паров воды.
При соединении металла и сильных минеральных кислот первый растворяется, особенно если смеси нагреть, в результате образуются соответствующие соли. Щелочи, расплавы и растворы окисляют вещество, в результате образуются цинкиты, растворимые в воде, и выделяется водород. Интенсивность воздействия кислот и щелочей зависит от наличия в цинке примесей. Чем более «чист» металл, тем слабее он взаимодействует из-за перенапряжения водорода.
Процесс литья
Литье бронзы начинается с подготовки рабочего места. Устанавливают подставку под опоку, тигель. Она делается из огнеупорного материала. Можно насыпать слой песка в поддон или воспользоваться металлической пластиной.
До загрузки измельченного лома в печь необходимо подготовить опоку. Ее хорошо прогревают, выдерживают минимум 2 часа при +600°C. Огнеупорный тигель при такой температуре начинает излучать желтоватое свечение. Пока прогретая форма остывает, приступают к плавлению измельченного лома.
Плавильню заполняют на 1/3 объема. С кусочками лома ставят в горячую печь, оставляют до полного плавления. Тигель или другую плавильную емкость устанавливают нагревать, когда температура в печи близка или достигла точки плавления бронзы. Оловянные бронзы становятся жидкими до 1000°C, безоловянные приходится прогревать дольше, у них точка плавления выше.
Когда вся бронз расплавится, ее оставляют в печи на 3-5 минут, чтобы расплав хорошо прогрелся, стал менее вязким. Затем плавильню достают щипцами или специальным крюком. Расплав готов. Пора приступать к изготовлению отливки.
Заливка бронзы в литейную форму
Расплавленный металл выливают в отверстие формы тонкой струйкой, бронза должна равномерно заполнить все пустоты. Она уплотняется под собственным весом. Чтобы горячая форма хорошо заполнялась, ее ставят на вращающуюся подставку с ручным или электрическим приводом. Такая хитрость необходима для получения качественного литья. Если заливать бронзу спокойно, углы отливки будут закругленными. Раскручивают форму с горячим расплавом в процессе заполнения. Когда бронза схватится, форму литья уже не изменить. В заводских условиях используют технологические центрифуги. В домашних условиях умельцы делают подобие промышленных установок на базе отслуживших стиральных машин.
Придавать сплаву движение необходимо при изготовлении небольших сложных отливок. Бронзовому расплаву не хватит собственного веса для заполнения всех пустот. Он будет застывать неравномерно, на поверхности литья возникнут раковины, складки.
Как сделать форму для литья
Самостоятельное изготовление литейной формы начинается с подбора корпуса, куда свободно войдет будущая отливка и останется свободным половина пространства. Это может быть жестяная банка или специально изготовленная емкость. Традиционно размер опоки в 1,3–1,5 раза превышает габариты отливки. Такое соотношение необходимо, чтобы песчано-глиняная смесь образовала равномерный слой со всех сторон детали. Наполнитель для опоки делается из материалов, способных сохранять тепло. Литая заготовка будет качественной только при постепенном остывании.
Форму делают из двух частей:
- верхняя рамка (занимает не менее 1/4 высоты формы);
- нижний ящик, в него свободно помещается будущая деталь.
Для набивки делают смесь песка и глины в пропорции 3:1. В глину для аккумуляции тепла вводят 1/5 часть угольной крошки, лучше использовать каменный уголь, у него больше теплоемкость. Однородную массу укладывают в обе части опоки. Смесь не стоит сильно утрамбовывать, чтобы глина не спекалась, оставалась рыхлой во время прогрева в печи. Деталь перед закладкой в подготовленный нижний ящик густо обмазывают тальком или графитовым порошком. Затем делается отверстие для заливки бронзы, разогретой до температуры плавления.
Готовую форму нужно просушить перед использованием.
Изделие достают из формы только после охлаждения. Форму аккуратно разбирают, затем вынимают отливку.
Технология получения литья более высокого качества
Получить литье нужной геометрии кустарным способом сложно. Нужно быть готовым к тому, что литье придется долго шлифовать, стачивать, доводить до нужных размеров. Процесс плавления бронзы в домашних условиях сопряжен с рядом ограничений. Нюансы, которые желательно учитывать при самостоятельном изготовлении бронзовых отливок:
- лучше использовать муфельную печь для плавки, оснащенную терморегулятором, производители предлагают небольшие установки для изготовления домашнего литья, работающие от стандартной сети 220 В;
- при изготовлении опоки необходимо учитывать сложность ее заполнения расплавом, в местах возможных пустот делают припуски на будущую доводку детали;
- вместо песочно-глиняных опок для мелких деталей делают гипсовые формы с восковым или парафиновым заполнением. Горячую бронзу при вливании вытесняет не воздух, а расплавленный стеарин.
Парафиновые формочки делают на основе гипсовых слепков, сделанных с будущей детали. Точность изготовления отливок в этом случае возрастает. Опоки из гипса удобны для небольших отливок, их можно сделать неразъемными. Правда, процесс их изготовления усложняется: сначала делятся форма для парафинового муляжа, а затем он заливается формовочным гипсом. Подобные конструкции удобно размещать в центрифуге.
Приступая к плавлению бронзового лома в домашних условиях, следует учитывать состав сплава. Она зависит от химического состава бронзы. Вязкий расплав бронзы медленно заполняет опоку. Чтобы не было пустот, заполненную форму крутят в центрифуге. Под действием центробежной силы металл, нагретый до температуры плавления, распределяется равномерно. Отливка получается качественной.
Содержание в природе
Как самостоятельный элемент цинк в природе не встречается. Его можно добыть из 66 минералов, среди которых сфалерит, каламин, франклинит, цинкит, виллемит, смитсонит. Первый является наиболее распространенным источником металла, его часто называют «цинковой обманкой». Он состоит из сульфида цинка и примесей, которые придают минералу разнообразные цвета. Это осложняет его поиск и правильное определение.
Найти цинк можно в кислых и изверженных породах — во последних его немного больше. Часто металл в виде сульфида вместе со свинцом встречается в термальных водах, мигрирует в поверхностных и подземных источниках.
Температура плавления и удельная теплоемкость цинка
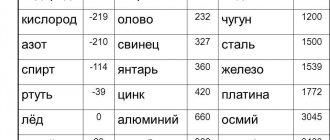
Температура плавления цинка — одна из самых низких среди используемых в промышленности металлов – 420 °C. При меньшей температуре плавятся олово (232 °С) и свинец (327 °С).
Температура плавления цинка – одна из самых низких.
Добавляя в цинк олово, можно понизить температуру плавления до 199 °С, а в сочетании с оловом и свинцом — до 150 °C. Температура плавления сплавов ниже, чем каждого отдельного элемента.
Немного истории
Р. Магграф первый разработал способ получения чистого цинка.
В чистом виде в лабораторных условиях металл удалось выделить дистилляционным способом. Произошло это в Великобритании в 1738 г. После многочисленных экспериментов в 1743 г. англичанами был разработан промышленный способ получения цинка. Через 3 года в Германии получили цинк из его солей методом их прокаливания без доступа кислорода. Образующийся металлический пар конденсировался в холодильнике. Позже были разработаны электрохимическая технология и технология получения металла методом проката при нагревании до 100–150 °C.
В России первый слиток цинка удалось получить в 1905 г. Древние люди, не зная о существовании цинка, заметили, что включение этого элемента вместе со свинцом в медную руду существенно снижает температуру плавления меди. Поэтому на определенном историческом этапе медь оказалась более востребованной, чем железо, которое плавится при более высокой температуре.
Описание и физические характеристики цинка
- В природе цинк в виде самородков не встречается. На сегодняшний день известно 66 видов минералов, содержащих этот элемент. Чаще всего они встречаются в кислых и вулканических породах, в термальных водах, могут залегать в глубоких слоях земной коры, откуда выносятся подземными водами.
- Самым распространенным минералом является «цинковая обманка». В ее состав входят сульфид цинка и различные примеси. Примеси придают минералам разнообразные цветовые оттенки, поэтому легко «обмануться» и неправильно распознать этот минерал, что усложняет его поиски и добычу.
- Свежий слиток имеет серебристый цвет, но очень быстро, подобно алюминию, свинцу, олову, покрывается оксидной пленкой и тускнеет.
- Удельная теплота плавления цинка равна 122 кДж/кг. Она определяет количество энергии, необходимое для плавления 1 кг цинка, нагретого до температуры плавления. Удельная теплота плавления цинка довольно высокая, она в 2 раз больше, чем у олова, и в 5 раза больше, чем у свинца.
- Удельная теплоемкость цинка 400 Дж/(кг*°С). Величина определяет количество энергии для увеличения температуры металла массой 1 кг на 1 °C. Она совпадает с удельной теплоемкостью меди и латуни. У свинца и олова удельная теплоемкость равны, соответственно, 140 и 230 дж/(кг*°С).
Удельная теплота плавления цинка равна 122 кДж/кг.
Приведенные значения показывают, что плавление цинка требует больших энергозатрат.
Применение цинка и его сплавов
Цинк — один из самых востребованных элементов. Он занимает 3-е место по объему производства среди цветных металлов. Первенство принадлежит меди и алюминию. Но в чистом виде он используется редко: при высоких температурах металл становится мягким, а при низких — хрупким. Процесс, где он применяется в чистом виде — восстановление драгоценных металлов из червонного свинца.
Около 40% произведенного металла используется для защиты стальных конструкций от механических повреждений и коррозии. Высокая степень антикоррозийной защиты объясняется большей, чем у железа, химической активностью. Поэтому цинковый слой вступает в реакции раньше, чем основная конструкция.
Раньше в типографиях использовалась цинковая краска для печати. В настоящее время ее относят к вредным веществам и вместо нее используют другие красители. Но цинковые белила используются и на сегодняшний день, хотя их производство сокращается. Главное их достоинство — высокая сцепляемость с окрашиваемой поверхностью, обеспечивающая качественное покрытие. Белила устойчивы к воздействию ультрафиолетового излучения, долго сохраняют свой цвет.
https://www.youtube.com/watch?v=o74G0zUgqTY
Цинковая пыль нашла применение в пиротехнике и фейерверках. Она придает пламени голубоватый оттенок.
Цинк – широко используется человеком.
Гораздо чаще применяются цинковые сплавы. Они имеют высокую температуру плавления и механическую прочность. Добавками служат медь, свинец, олово, алюминий, магний.
Сплавы широко применяются в автомобильной, авиационной промышленности, в производстве бытовой техники.
Широкое распространение получили источники тока с электродами из ртутно-цинковых и серебряно-цинковых сплавов.
Особенности выплавки
Температура, необходимая для плавления цинка, должна быть меньше 419 C о, но и не больше 480 C о. В противном случае вырастет угар металла и повысится износ стенок ванны, которую стандартно производят из железа. В расплавленном состоянии допускается не более 0,05% примеси железа, иначе температура, нужная при плавлении, начнет повышаться. Если процент содержания железа будет превышать 0,2%, цинк нельзя будет подвергать прокатке.
Цинк получают из полиметаллических руд, в которых может содержаться до 4% элемента. Если руды были обогащены селективной флотацией, из них можно получить до 60% цинковых концентратов, остальное будет занято концентратами других металлов. Цинковые концентраты обжигают в печах в кипящем слое, после чего сульфид цинка переходит в оксид, и выделяется сернистый газ. Последний идет в расход: из него получают серную кислоту.
Чтобы перевести оксид цинка в сам металл, используют два способа.
- Дистилляционный или пирометаллургический. Концентрат обжигают, затем подвергают спеканию, чтобы придать газопроницаемости и зернистости и восстанавливают при помощи кокса или угля при воздействии температуры в 1200-1300 C о. Во время реакции образуются пары металла, который конденсируют и разливают в изложницы. Чистота цинка достигает 98,7%, после можно повысить ее до 99,995% при помощи ректификации, но последний способ достаточно дорогой и сложный.
- Электролитический или гидрометаллургический. Обожженные концентраты обрабатывают серной кислотой, раствор очищают от примесей при помощи цинковой пыли и подвергают электролизу в выложенных изнутри свинцом или винипластом ваннах. Цинк оседает на алюминиевых катодах, откуда его собирают и плавят в индукционных печах. Чистота металла, полученного этим способом, достигает 99,95%.
Сырье для получения цинка
Основным источником получения цинка являются сульфидные, медно-свинцово-цинковые, медно-цинковые и свинцово-цинковые руды.
В сульфидных рудах цинк обычно присутствует в виде сфалерита или вуртцита, состав которых отвечает формуле ZnS, и марматита nZnS · mFeS. Спутниками цинка в полиметаллических рудах являются минералы и элементы.
В окисленных зонах месторождений цинксодержащих руд основными кислородсодержащими минералами цинка являются: смитсонит ZnCO3, цинкит ZnO и каламин ZnO·SiO2 ·H2O. Окисленные цинковые руды в настоящее время имеют подчиненное значение.
В сульфидных полиметаллических рудах содержание цинка обычно составляет 1…3 %. Эти руды имеют сложный состав. Все это обусловливает необходимость проведения предварительного обогащения руд по селективной схеме с получением нескольких концентратов.
Цинковые концентраты селективного флотационного обогащения полиметаллических руд содержат, %: Zn – 48…60; Pb – 1,5…2,5; Cu – 1…3; Cd – до 0,25; Fe – 3…10; S – 30…38, пустой породы – до 10.
Цинковые концентраты – комплексное дорогостоящее сырьё. Из них нужно извлекать цинк, свинец, медь, кадмий, серу, золото, серебро, ртуть, галлий, индий, таллий, селен, теллур и др.
Иногда при обогащении труднообогатимых медно-цинковых руд получают промежуточные продукты, содержащие 12…18 % Zn и 4…8 % Cu. Переработка этих материалов затруднена как на цинковых, так и на медных заводах.
Переработку цинковых концентратов в настоящее время осуществляют двумя методами – пирометаллургическим и гидрометаллургическим.
В основе пирометаллургического способа лежит процесс восстановления оксида цинка при 1000…1100 ºС, т. е. при температуре выше точки кипения металлического цинка, что обеспечивает выделение его в момент образования в парообразном состоянии и возгонку в виде паров:
ZnO + C = Znпар + CO; ZnO + CO = Znпар + CO2.
Пары цинка в дальнейшем конденсируют. Получение жидкого цинка дистилляцией возможно только в условиях сильно восстановительной атмосферы и полной герметизации применяемой аппаратуры.
В связи с тем что цинковый концентрат представляет собой сульфидный материал, а восстановление цинка возможно только из его оксида, дистилляции предшествует окислительный обжиг с полным удалением серы.
Возможны несколько вариантов аппаратурного оформления пирометаллургического способа получения цинка: в горизонтальных и вертикальных ретортах, в шахтных и электрических печах. Принцип действия положен в основу получения паров цинка в электротермической части кивцетного агрегата.
Получающийся пирометаллургическим способом цинк обязательно содержит большое количество металлов-примесей, возгоняемых вместе с ним или попадающих в него из выносимой газами пыли. Поэтому дистилляционный цинк, как и всякий черновой металл, нуждается в рафинировании.
Пирометаллургический способ применяют с момента возникновения цинкового производства. Доля выпуска цинка этим способом из года в год сокращается и в настоящее время составляет не более 20 %.
Гидрометаллургический способ является в настоящее время основным. Широкое распространение гидрометаллургии при производстве цинка обусловлено ее значительными преимуществами по сравнению с дистилляцией. К ним относятся:
- извлечение большего количества цинка и сопутствующих элементов;
- большая комплексность использования сырья;
- высокое качество цинка;
- высокая механизация трудоемких процессов.
По этому способу цинк выщелачивают раствором серной кислоты из предварительно обожженного концентрата. При выщелачивании цинк переходит в раствор в виде сернокислого цинка по реакции
ZnO + H2SO4 = ZnSO4 + H2O.
При выщелачивании цинкового огарка в раствор частично переходят содержащиеся в нем компоненты. Качество получаемого электролитическим осаждением цинка зависит от чистоты раствора: чем чище раствор, поступающий на электролиз, тем более чистым получается товарный цинк. Поэтому перед электролизом раствор тщательно очищают от примесей.
Процесс электролитического осаждения цинка из очищенного раствора протекает по следующей суммарной реакции:
ZnSO4 + H2O = Zn + H2SO4 + 0,5O2
Цинк при электролизе осаждается на катоде, а на аноде регенерируется серная кислота, необходимая для выщелачивания свежих порций огарка, и выделяется кислород. Катодные осадки цинка переплавляют и разливают в слитки.
Кек (нерастворенный осадок), получаемый после выщелачивания, подвергают дополнительной переработке с целью доизвлечения из него цинка и других ценных компонентов.
Смеси и сплавы
Для усиления прочности и увеличения температуры плавления металл смешивают с медью, алюминием, оловом, магнием и свинцом.
Самым известным и востребованным сплавом является латунь. Это смесь меди с добавлением цинка, иногда встречаются и олово, никель, марганец, железо, свинец. Плотность латуни достигает 8700 кг/м3. Температура, нужная для плавления, держится на отметке 880 C о — 950 C о: чем больше в ней содержание цинка, тем она ниже. Сплав отлично сопротивляется неблагоприятной внешней среде, хоть и чернеет на воздухе, если не покрыта лаком, прекрасно полируется и сваривается контактной сваркой.
Существует два вида латуни:
- Альфа-латунь: более пластична, хорошо гнется в любом состоянии, но сильнее изнашивается.
- Альфа+бета-латунь: деформируется только при нагревании, при этом более износостойка. Часто сплавляют с магнием, алюминием, свинцом и железом. Это позволяет увеличить прочность, но уменьшает пластичность.
Сплав Zamak или Zamac состоит из цинка, алюминия, меди и магния. Само название образовано из первых букв латинских названий: Zink — Aluminium — Magnesium — Kupfer / Cuprum (Цинк-Алюминий-Магний-Медь). В СССР сплав был известен как ЦАМ: Цинк-Алюминий-Медь. Активно применяется в литье под давлением, плавление начинается при низкой температуре (381 C о — 387 C о) и имеет низкий коэффициент трения (0,07). Обладает повышенной прочностью, что позволяет получать изделия сложной формы, которые не боятся сломаться: дверные ручки, клюшки для гольфа, затворы огнестрельного оружия, строительную фурнитуру, застежки разных видов и рыболовные снасти.
Небольшой процент цинка (не более 0,01%) содержится в гартовых сплавах, применяемых в полиграфии для отливки типографских шрифтов и линеек, печатных форм и машинного набора. Это устаревшие смеси, на место которых пришел чистый цинк с небольшим добавлением примесей.
Невысокая температура, которая требуется для плавления цинка, часто компенсируется за счет сплавов с другими металлами, но бывает и наоборот. Если температура, необходимая для плавления «чистого» металла, составляет 419,5 C о, то сплав с оловом снижается до 199 C о, а с оловом и свинцом — до 150 C о. И хотя такие сплавы можно паять и варить, чаще всего смеси с цинком применяют только для заделки имеющихся дефектов из-за их слабой прочности. Например, сплав олова, свинца и цинка рекомендуется применять только на никелированных изделиях.
Чаще всего цинковые сплавы применяют для создания карбюраторов, рам спидометров, радиаторных решеток, гидравлических тормозов, насосов и декоративных элементов, деталей для стиральных машин, миксеров и кухонного оборудования, часовых корпусов, пишущих машинок, кассовых аппаратов и бытовой техники. Эти детали нельзя применять в промышленном производстве: при повышении температуры до 100 C о прочность изделия снижается на треть, а твердость — почти на 40%. При понижении температуры до 0 C о цинк становится слишком хрупким, что может привести к поломке.
Технология плавки
Основную часть шихты обычно составляют сплавы цинковые литейные в чушках, свой возврат и лом цинковых сплавов. В качестве покровных флюсов используют смесь хлоридов кальция, калия и натрия, хлористый аммоний или криолит. Для подшихтовки используют первичный алюминий в чушках, катодную медь и магний металлический. Все компоненты шихты должны быть очищены от масел, влаги и других включений. Плавку ведут, не допуская перегрева ванны выше 480 °С. По результатам экспресс-анализа проводят корректировку химического состава. Для ввода магния используют стальной колокольчик. При получении заданного химического состава металл перегревают до 440…450°С и переливают в ковш, нагретый до той же температуры. В ковше под вытяжным зонтом производят рафинирование расплава таблетками комплексного дегазатора «Дегазер», в составе которых 87% гексахлорэтана, 12,7% NaCl, 0,3% ультрамарина. Рафинирование можно проводить также отстаиванием, продувкой инертными газами и фильтрацией.
Применение
Цинк является одним из наиболее востребованных металлов в мире: он находится на третьем месте по объему добычи среди цветных металлов, уступая только меди и алюминию. Этому способствует и его невысокая цена. Чаще всего его применяют для защиты от коррозии и в качестве части сплава, например, латуни.
- В металлургии цинк особенно ценен. Его наносят тонким слоем на стальную поверхность многих металлоконструкций, чтобы полностью защитить их от ржавчины на механическом и химическом уровне. На это расходуется до 40% от всей добычи. Поскольку цинк, в отличие от никеля, кобальта, олова и кадмия, активнее железа, он первым начинает контактировать с недружелюбной внешней средой, полностью защищая основу.
- Чистый металл используют для восстановления благородных металлов после добычи путем выщелачивания. Также с его помощью происходит добыча золота и серебра из чернового свинца.
- Цинк является наиболее электроположительным металлом, практически не реагирующим на воду. Это позволило создать большое число разнообразных химических источников тока: воздушно-цинковые, серебряно-цинковые, ртутно-цинковые, «сухие» элементы Лекланше.
- Цинковую пыль используют в фейерверках и пиротехнике для создания голубого огня, в краске, особенно в цинковых белилах — для антикоррозийной защиты и лучшего прилипания к основе. Она же применяется для вытеснения драгоценных металлов из цианистых растворов и для очистки раствора сульфата цинка от кадмия и меди.
- В полиграфии цинк применяют для отливки шрифтов и печать иллюстраций: цинкография применяется с XIX века. При этом типографское клише готовится на цинковой основе с небольшим — не более 5% — добавлением других металлов. Перед каждым травлением пластину отжигают и прокатывают в нагретом состояние.
- В медицине оксид цинка используют в качестве антисептика в мазях «Паста Лассара», «Судокрем», «Цинковая мазь», а также в качестве присыпки, зубных паст и материала для цементирования зубов. Применяют металл для создания бактерицидных потолков и самоочищающихся поверхностей. Раньше цинк применяли для фотокаталитической очистки воды в промышленных масштабах.
В живых организмах
В теле человека содержится около 2 граммов цинка, около 400 ферментов содержат его. К последним относятся ферменты, катализирующие гидролиз белков, сложных эфиров и лептидов, полимеризацию РНК и ДНК, образование альдегидов. Чистый элемент содержится в мышцах, поджелудочной железе и печени. В день мужчинам требуется 11 мг цинка, женщинам — 8 мг.
В организме цинк выполняет следующие функции:
- Нормализует деятельность простаты;
- Способствует метаболизму витамина Е;
- Принимает участие в синтезе анаболических гормонов: гормоне роста, инсулине, тестостероне и других;
- Участвует в продукции мужских гормонов и спермы;
- Помогает расщепить алкоголь в организме.
При недостатке элемента в организме наблюдается быстрая утомляемость, раздражительность, потеря памяти, снижение зрения и веса без объективной причины, приступы аллергии, депрессивное состояние. Происходит понижение уровня инсулина и накопление в теле некоторых элементов: железа, свинца, меди, кадмия.
В продуктах питания
Элемент имеется в мясе, сыре, кунжуте, устрицах, шоколаде, бобовых, овсянке, подсолнечных и тыквенных семечках, часто присутствует в минеральной воде. Наибольший процент цинка содержится в следующих продуктах (из расчета на 100 грамм):
- Устрицы (до 40 мг), анчоусы (1,72 мг), осьминог (1,68 мг), карп (1,48 мг), икра (до 1 мг), сельдь (около 1 мг).
- Тыквенные семечки (10 мг), кунжут (7 мг), подсолнечные семечки (5,3 мг), арахис (4 мг), грецкие орехи (3 мг), миндаль (3 мг).
- Говядина (до 8,4 мг), баранина (до 6 мг), говяжья печень (4 мг), свинина (до 3,5 мг), курица (до 3,5 мг).
- Какао-порошок без сахара и подсластителей (6,81 мг), чистый горький шоколад (2,3 мг), шоколадные конфеты (до 2 мг в зависимости от количества и вида шоколада).
- Чечевица (4,78 мг), овес (3,97 мг), пшеница (3,46 мг), соевые бобы (3 мг), рожь (2,65 мг), хлеб (до 1,5 мг), зеленый горошек (1,24 мг), горох (1,2 мг), ростки бамбука (1,1 мг), рис (1 мг), злаковое печенье (до 1 мг).
- Твердый сыр (до 4 мг).