Что такое бронза?
Бронза является сплавом меди и олова. Металлургические бронзы кроме этого обычно содержат еще несколько легирующих добавок. Гальванические же бронзы практически всегда двух- или трехкомпонентны, причем в качестве третьего компонента часто выступает цинк. Сегодня покрытия бронзами ограниченно применяются в промышленности, по сравнению с оловом, цинком или никелем. Во многом здесь сказался исторический фактор, т.к. ранее никель был дефицитным и его замена белой бронзой была экономически оправдана, несмотря на то, что само по себе бронзирование сложнее, чем никелирование. Сегодня ситуация поменялась — никель и олово равнодоступны для предприятий и находятся примерно в одной ценовой категории. Но, все же, гальванические бронзы обладают рядом уникальных свойств, из-за которых они имеют право на жизнь. Сами по себе гальванические бронзы делятся на белые (Sn 40-50%) и желтые (Sn 10-20%). В данной статье речь пойдет о процессе осаждения белой бронзы.
Как покрасить хромированную деталь
Хромированные детали являются довольно спорным элементом декора автомобилей, что вызвано его явной броскостью. Многие автолюбители считают себя ярыми противниками хромированных деталей и стараются всячески закамуфлировать такие украшения производителей авто путем их заклеивания пленкой или покраской. Те же, кто спокойно относиться к хрому, также часто вынуждены маскировать декор из-за царапин или трещин на нем. Да, хромирование не является особо стойким напылением и часто затирается или даже вздувается на радиаторных решетках, что выглядит весьма нелицеприятно.
Общие сведения о гальванических белых бронзах.
Гальванические белые бронзы далее разделяются на два основных подвида: • Двухкомпонентные (медь-олово). Классическим считается состав с 40% олова, хотя эта цифра может колебаться в пределах 35-50%; • Трехкомпонентные (медь-олово-цинк). Состав с 7% цинка называется Триаллоем. Покрытия белыми бронзами имеют ряд общих свойств: • Любые белые бронзы устойчивы к коррозии в обычной воздушной атмосфере. • При нагревании до 300о С на воздухе они окисляются.
Рисунок 1 — Результат термического окисления белой бронзы на алюминиевом контакте с подслоем никель-фосфор. Нагревание выполнено путем приваривания контакта к алюминиевой шине.
• Пористость покрытий белыми бронзами меньше, чем у никеля на аналогичных толщинах. • Белые бронзы имеют высокий коэффициент отражения света и могут применяться в рефлекторах. • В серосодержащих промышленных атмосферах белые бронзы обладают гораздо более стабильным переходным сопротивлением, чем серебро, что определяет главную область их применения — защита электроконтактов. • Электроосажденная белая бронза является катодом к латуни в морской воде, поэтому она не должна иметь пор и повреждений, доходящих до основы.
Существует и ряд отличий между двух- и трехкомпонентной белой бронзой: • При отсутствии цинка белая бронза ближе по цвету к олову, с цинком — ближе к никелю. Цинкосодержащие бронзы имеют яркие блестящие поверхности даже при концентрации олова значительно ниже 20% масс. • Цинксодержащие бронзы по совокупности параметров осаждаются на 40% быстрее, чем соответствующие двойные сплавы. • Цинкосодержащие бронзы менее пористы, чем свободные от цинка. • Бинарная бронза с высоким содержанием олова тверже по сравнению с тройными сплавами, что делает их предпочтительным выбором, если требуется устойчивость к царапинам, износу и эрозии. • Цинксодержащие белые бронзы нашли применение при покрытии высокочастотных электроконтактов (рисунок 2).
Рисунок 2 — Примеры высокочастотных электроконтактов с покрытием белой бронзой. • Потенциал двухкомпонентной бронзы более катодный по отношению к латуни, чем трехкомпонентной. • Сопротивление анодной поляризации у двухкомпонентной бронзы выше, чем у трехкомпонентного сплава. • У двухкомпонентной бронзы коррозия идет локально, у трехкомпонентной — равномерно и однородно. • В морской среде коррозионная стойкость двухкомпонентной бронзы выше, чем трехкомпонентной. Диаграмма теплового равновесия бронз (рисунок 3) имеет сложный характер.
Рисунок 3 —
Диаграмма теплового равновесия бронз. Имеется целый ряд возможных фаз, которые не обязательно являются равновесными, стабильными при комнатной температуре. Большое количество неравновесных и интерметаллических фаз существует вплоть до 50% олова. Само по себе гальваническое осаждение бронзы также является неравновесным процессом, что еще более усложняет дело. Т.е в электроосажденном сплаве могут присутствовать фазы, которые обычно не стабильны при комнатной температуре.
Ранние рентгеноструктурные исследования Бехарда и позднее Рауба и Соттера подтвердили, что фазы в электроосажденных бронзах существуют в более широком диапазоне составов, чем те, которые можно найти в металлургических бронзах. Принципиальным моментом в кинетике осаждения классической белой бронзы является высокая разность стандартных потенциалов меди и олова. Еще более трудным случаем является осаждение трехкомпонентного сплава, т.к. у всех трех металлов потенциалы сильно отличаются. Данное обстоятельство означает, что без применения лигандов и функциональных добавок соосаждение меди, олова, и, тем более, цинка, будет невозможно. Наиболее популярными лигандами являются цианиды.
Большую роль в вопросе состава получаемого сплава играет рабочая плотность тока. В целом, связь между плотностью тока и составом сплава при нерегулярном (аномальном) соосаждении является сложной и обычно непредсказуемой. При нормальном соосаждении Cu осаждается при более положительном потенциале, чем Sn, при аномальном — наоборот. Однако C.T.J.Lowetal. продемонстрировали, что как нормальное осаждение сплава, так и аномальное, может быть достигнуто в зависимости от концентрации меди и добавок в ваннах.
Рауб и Сауттер показали, что твердость гальванических бронз достигает максимума около 550 VHN при 40% Sn. Т.е первым фактором здесь выступает состав сплава. Это согласуется с исследованиями, проведенными Раманатаном, который получил максимальную твердость 520 VHN при том же составе. Мензис обнаружил, что микротвердость бронз увеличивается с повышением температуры ванны. Максимальная твердость была получена из цианидной ванны при 70°C, хотя этот осадок не имел самого высокого содержания олова. Таким образом, твердость гальванических бронз связана также с температурой ванны, а не только с составом или структурой покрытия.
Особенности процесса
Покрытие, формируемое на обрабатываемой детали при помощи гальваники, может наноситься в технологических целях либо выполнять декоративные, защитные или сразу обе функции. В декоративных целях создают тонкий слой золота или серебра, а чтобы обеспечить надежную защиту поверхности обрабатываемой детали от коррозии, выполняют цинкование или гальваническое меднение.
Схема процесса электролиза
Сделать гальванику даже в домашних условиях несложно. Выполняют такую процедуру следующим образом.
- В диэлектрическую емкость с электролитом опускают два анода, подключаемые к плюсовому контакту источника электрического тока. Материалом изготовления таких анодов должен быть металл, слой из которого необходимо сформировать.
- Гальванизация, то есть процесс переноса молекул металла с электролита на изделие-катод, начинает происходить в тот момент, когда замыкается полученная электрическая сеть.
Само обрабатываемое изделие, подключаемое к минусовому контакту источника электрического тока и, таким образом, выступающее в роли катода, помещается в электролите между анодами.
В результате на обрабатываемой поверхности формируется тонкий и однородный слой металла, который изначально содержался в химическом составе электролита.
Схема гальванической установки
Осаждение бронзы из простого электролита без добавок.
Невозможность осаждения бронз из простых ванн без добавок подтверждается экспериментально. На рисунке 4 показаны кривые циклической вольтамперометрии при осаждении из электролитов, содержащих медь, олово и одновременно медь с оловом. Добавки, кроме серной кислоты, и лиганды в электролит не вводились. Процесс велся на стальном вращающемся дисковом электроде при скоростях 0, 100 и 500 оборотов в минуту.
Рисунок 4 — Циклические вольтамперограммы на стальном вращающемся дисковом электроде в электролитах: а — 0,1М CuSO4, b — 0,1М SnSO4, c — 0,1М CuSO4 + 0,1М SnSO4. Во всех случаях в электролиты вводили 1,4М H2SO4. Добавки не применялись.
На кривых точно видны два потенциала: начала восстановления и анодного растворения указанных металлов. Восстановление Cu2+ до Cu0 начиналось в диапазоне от -0,017 до -0,112 В, в зависимости от скорости вращения электрода (рисунок 4а). При анодной поляризации наблюдались одиночные скачки тока, появляющиеся при 0,05 В и имеющие разные площади пиков.
В случае олова (рисунок 4b) потенциал начала восстановления находился в диапазоне от -0,464 до -0,414 В, в зависимости от скорости вращения электрода. После начала процесса плотность тока скачкообразно возрастала при -0,5 В и впоследствии уменьшалась. При совместном присутствии в электролите меди и олова без добавок (рисунок 4c) первый потенциал начала восстановления меди составлял -0,022 В при 0 об/мин, -0,134 В при 100 об/мин и -0,196 В при 500 об/мин. Предельный ток достигался при -0,48В. При дальнейшей катодной поляризации от -0,5В плотность тока снова увеличивалась, что говорило о начале восстановления олова. Таким образом, в смешанном растворе на катодных ветвях вольтамперограммы обнаруживались два четко разделенных скачка тока, характеризующих восстановление меди и олова. Это означает, что соосаждения их не было и бронза не образовывалась.
Поскольку медь предпочтительнее восстанавливается из-за ее более положительного стандартного потенциала, в электролите без добавок и лигандов на катоде меди осаждалось гораздо больше, чем олова. Это согласуется с профилем сканирования в режиме анодной поляризации. Большие пики анодного растворения обнаруживались в диапазоне от 0,18 до 0,28В в электролите, содержащем только медь (рисунок 4а), и от -0,44 до -0,38В в электролите, содержащем только олово (рисунок 4b). В смешанном же растворе наблюдались очень маленькие пики между -0,45 и -0,42 В и большой пик при 0,167 В. Таким образом, это является еще одним доказательством того, что электрохимическое восстановление в смешанном растворе Cu/Sn в основном приводит к осаждению меди.
Как правильно подготовить изделие к процедуре
После того как вы изготовили свой гальванический аппарат, нашли все необходимое оснащение и химические составляющие, можно приступать к такому важному процессу, как подготовка изделия, которое будет подвергаться гальванике. Важность такого процесса очень сложно переоценить, так как именно от качества его выполнения во многом зависит то, какими характеристиками будет обладать готовое покрытие.
В большинстве случаев подготовка изделия к гальванике не ограничивается только очисткой его поверхности от загрязнений и ее обезжириванием. Выполняются также пескоструйная обработка и последующая шлифовка с использованием наждачной бумаги и специальных паст.
Цианидный электролит белого бронзирования.
Этот тип ванны, вероятно, наиболее широко изучен и имеет наибольшее коммерческое значение. Состав ванны включает цианидные комплексы меди с избытком свободных цианидов натрия или калия, а также гидроксиды и станнаты в различных количествах, в зависимости от состава требуемого осадка. Цианиды калия лучше натрия с точки зрения электропроводности. Основными недостатками цианидных ванн является токсичность и склонность к карбонизации на воздухе. Последний фактор особенно обостряется, если ванна работает с сильным нагревом. Блескообразователи играют важную роль в этих ваннах, могут влиять на кинетику процесса и физические свойства осадков. При введении соответствующих добавок из цианидных электролитов образуются гладкие, яркие и почти зеркальные бронзовые покрытия. Добавки могут быть неорганическими или органическими по своей природе, многие из них зашифрованы и запатентованы.
4.1 Влияние температуры.
Установлено, что повышение температуры увеличивает выход покрытия по току, повышает содержание олова в осадке и его твердость. Однако, при нагреве цианид натрия разлагается гораздо быстрее, особенно при температурах выше 65°С. При температурах же ниже 40°С олово почти не осаждается и образуются осадки, состоящие в основном из меди.
4.2 Влияние плотности тока.
При увеличении плотности тока резко снижается выход по току. При осаждении белой бронзы диапазон допустимых плотностей тока уже, чем для желтой.
Установлено, что состав сплава, полученного при различных плотностях тока, изменяется, но неравномерно. Некоторые исследователи сообщали, что с ростом плотности тока содержание олова в осадке увеличивается, однако были и противоположные мнения.
4.3 Влияние концентраций цианидов и гидроксидов.
С увеличением концентрации цианидов и гидроксидов в ванне происходит заметное снижение катодного выхода по току. Было обнаружено, что увеличение содержания свободных гидроксидов в ванне значительно снижает скорость осаждения олова, но почти не влияет на скорость осаждения меди. Увеличение содержания свободного цианида значительно снижает скорость осаждения меди и оказывает гораздо меньшее влияние на скорость осаждения олова. Это можно резюмировать следующим образом: увеличение содержания гидроксида уменьшает содержание олова в покрытиях, а увеличение содержания цианида увеличивает.
4.4 Влияние концентрации металлов в ванне.
Значительное увеличение содержания олова в ванне приводит к возрастанию количества олова в покрытии всего на несколько процентов. Повышение концентрации металлов в ванне в целом увеличивает выход по току.
4.5 Влияние карбоната в гальванических ваннах.
Карбонаты в цианидной ванне накапливаются различными способами. Они могут образовываться при взаимодействии атмосферного углекислого газа с гидроксидами или при его взаимодействии с разлагающимися цианидами в присутствии кислорода. Карбонаты могут также образовываться на аноде при разложении цианидов.
Установлено, что определенное количество карбоната оказывает благоприятное действие на процесс осаждения белой бронзы за счет увеличения электропроводности раствора и, таким образом, увеличения рассеивающей способности. Установлено, что содержание карбоната калия до 100 г/л увеличивает РС бронзовых ванн. Дальнейшее увеличение содержания карбоната калия выше этого значения приводит к снижению РС.
Увеличение содержания карбоната калия в гальванической ванне приводит также к снижению выхода по току.
4.6 Электродные реакции в цианидной ванне бронзирования.
Общепринято, что олово осаждается из раствора посредством простых ионов, которые образуются при гидролизе или диссоциации станнатного комплекса:
SnО32- + 3H2О → Sn4+ + 6OH-
затем:
Sn4+ + 4e → Sn0
Возможен и прямой разряда комплекса:
SnО32- + 3H2О + 4e → Sn0 + 6ОH-
Приведенная выше реакция показывает, что на каждый атом осажденного олова приходится шесть гидроксильных ионов. Это приводит к чрезмерному росту рН в диффузионном слое катода. Диссоциация цианидного комплекса меди идет по реакции:
Cu(CN)32- → Cu+ + 3CN-
Cu+ + e → Cu
Первая реакция диссоциации не так проста, как может показаться. Изменение концентрации свободного цианида в растворе оказывает необычное влияние на электродный потенциал. По мере разбавления раствора было бы разумно предположить, что электродный потенциал станет более отрицательным или менее благородным, как для электродов в растворах простых ионов. Однако электродный потенциал для меди становится более положительным (более благородным), поскольку раствор цианида становится более разбавленным. Одна из теорий объясняет это тем, что при изменении концентрации цианида происходят различные электродные реакции и наблюдаемый потенциал представляет собой смесь потенциалов, связанных с несколькими реакциями разряда. Ряд комплексов, образующихся при увеличении концентрации цианида в растворе, может быть следующим:
Cu(CN)2- → Cu(CN)32- → Cu (CN)43-
Все эти комплексы существуют в растворе и их потенциал возрастает с увеличением числа цианидных лигандов. Таким образом, потенциал становится более отрицательным по мере увеличения содержания цианида в ванне.
Никелирование
Покрытие металла слоем никеля в домашних условиях могут выполнять в качестве финишной обработки или перед хромированием. Такой процесс получил название «гальваностегия», так как наносимый на поверхность изделия слой никеля повышает ее устойчивость к негативным факторам внешней среды. Кроме высоких защитных свойств, никелевый слой отличается и декоративной привлекательностью.
Температура электролита при выполнении никелирования не превышает 25°, а плотность тока находится в пределах 1,2 А/дм 2 . Электролит, кислотность которого должна находиться в пределах 4–5 pH, представляет собой водный раствор, в состав которого входят такие химические элементы, как сульфат никеля, магний, натрий, пищевая соль, борная кислота.
После завершения процесса гальваники изделие извлекают из электролитического раствора, промывают в воде, тщательно просушивают и полируют.
Нецианидный электролит белого двухкомпонентного бронзирования.
При введении ряда добавок в сернокислый нецианидный раствор бронзирования кинетика осаждения покрытия изменяется. Циклическая вольтамперометрия в электролите с четырьмя функциональными добавками проводилась при скорости сканирования 50 мВ/с и вращении стального дискового электрода 100 об/мин. На рисунке 5а показаны кривые, полученные в растворе, содержащем две специальных добавки.
Рисунок 5 —
Поляризационная кривая осаждения сплава медь-олово в электролите, состоящем из 0,1М CuSO4 и 0,1М SnSO4 в 1,4 М H2SO4 с: а — отдельными добавками, b — с хелатирующим лигандом, c — с антипиттинговой добавкой.
При введении добавок потенциал начала восстановления меди сдвигался к более отрицательному значению, а предельная плотность тока снижалась. Теоретически вводимые в исследовании добавки не диссоциируют в ванне при pH<1,0, что намного ниже их значений pKa. Однако с ними могут образовываться комплексы Cu2+ в прикатодной области, где рН выше за счет выделения водорода.
Согласно рисункам 5b и с, в присутствии хелатирующего агента или антипиттинговой добавки потенциал начала восстановления меди смещался в сторону потенциала выделения олова. В то же время потенциал восстановления олова не менялся и равнялся -0,484 В независимо от присутствия этих компонентов. Общая предельная плотность тока снижалась.
На рисунке 6а показаны результаты измерений в диапазоне потенциалов от 0,6 до -0,6 В в электролите, содержащем две комплексные добавки, хелатирующий лиганд и антипиттинговую добавку. Видно, что восстановление начиналось примерно с -0,2 В, большой пик тока проявлялся около -0,43 В. На этом графике потенциал начала восстановления олова пересекался с потенциалом восстановления меди, что означало возможность сплавообразования.
Рисунок 6 — Циклические вольтамперограммы осаждения сплава медь-олово в электролите, состоящем из 0,1М CuSO4 и 0,1М SnSO4 в 1,4М H2SO4 со всеми добавками: а — вся кривая, b — увеличение отдельной области кривой.
При сканировании в анодную область крупные пики тока были видны при -0,5В (олово) и 0,13 В (медь) соответственно, что свидетельствовало об успешном осаждении Cu-Sn в этих условиях. В отличие от осаждения меди и олова без добавок, где площадь пика растворения меди значительно превышала площадь пика растворения олова. Кроме того, на потенциалы восстановления практически не влияла скорость вращения дискового электрода. Т.е. влияние массоопереноса при осаждении бронзы в электролите с добавками было незначительным (рисунок 4b).
На рисунке 7 показаны цвета покрытий бронзой в зависимости от плотности тока и времени нанесения гальванического покрытия.
Рисунок 7 —
Влияние плотности тока и времени осаждения на цвет получаемой бронзы.
Видно, что рост плотности тока приводит к изменению цвета покрытия от белого к красному. Это означает, что с ростом плотности тока доля осаждаемой меди в сплаве увеличивается.
На рисунке 8 показаны электронномикроскопические изображения поверхности Cu-Sn после осаждения из электролита со всеми четырьмя добавками.
Рисунок 8 — СЭМ-изображения поверхности покрытий сплавом Cu-Sn, осажденных в смешанном растворе, в зависимости от плотности тока при А/дм2: а — 0,5, b — 1, c — 2, d — 3, e — 5, f — 6. В зависимости от времени при 1 А/дм2: g — 10 минут, h — 20 минут и i — 45 минут.
На них видна компактная структура и однородная морфология поверхности, причем размер зерен увеличивался одновременно с плотностью тока (рисунок 8a-f) и временем осаждения (g-i).
Изображение поперечного сечения этого покрытия приведено на рисунке 9a. Видно, что покрытие компактное, однородное и это согласуется с предыдущими данными.
Результаты EDS-анализа данного шлифа с картированием приведены на рисунке 9 (Cu и Sn). Как медь, так и олово демонстрируют равномерное распределение по шлифу без агломераций.
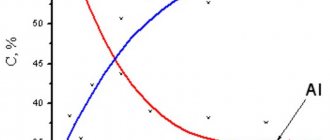
Рисунок 9 — Комплексные данные: a — СЭМ-изображение поперечного сечения пленки сплава Cu-Sn, осажденной при 1 А/дм2 в течение 30 минут с результатами EDS шлифа для меди и олова; b,c — график содержания меди и олова на поверхности покрытия сплавом Cu-Sn в зависимости от плотности тока и времени осаждения соответственно.
Рисунок 9b показывает, что при минимальной плотности тока осаждается сплав с 50% олова. Эта доля постоянно уменьшается, доходя до 35% по мере увеличения плотности тока, что хорошо согласуется с результатом оценки цвета покрытия (рисунок 7). Таким образом, на ярко-белый цвет поверхности влияет именно соотношение Sn/Cu, а не размер и толщина зерна, связанные с плотностью тока.
На основании рентгено-фазового анализа (рисунок 10) можно заключить, что пленки сплава Cu-Sn в основном состоят из меди и олова с включениями интерметаллидов Cu6.26Sn5 и Cu6Sn5 для всех образцов, независимо от плотности тока.
Рисунок 10 — Рентгенограммы пленок сплава Cu-Sn, осажденных при плотностях тока от 0,5 до 6 А/дм2 в смешанном растворе с четырьмя функциональными добавками.
По мере увеличения плотности тока интенсивность пиков на углах 42,6о и 78,6о, которые соответствуют интерметаллическим соединениям Cu6.26Sn5 / Cu6Sn5 (карты JCPDS №47-1575 и №45-1488) и оксидам олова SnO/SnO2 (карты JCPDS №06-0395 и № 41-1445), постепенно уменьшалась. Это происходило из-за увеличения количества Cu/Cu2O и уменьшения количества металлического Sn на поверхности покрытия. Данный результат согласуется с результатами EDS-анализа.
Состав поверхности сплава Cu-Sn можно уточнить на основании РФЭС-анализа, результаты которого приведены на рисунке 11. Спектры высокого разрешения Cu 2p3/2 в основном показывали пики Cu0/1+ при 933,0 эВ (0,5 A/дм2) и 932,7 эВ (6 А/дм2) с очень маленьким проявлением Cu2+. Это означает, что в поверхностном слое сплава Cu-Sn в основном преобладает Cu2O/Cu. При повышенных плотностях тока пик Cu 2p3/2 немного сдвигался в сторону более низких энергий связи из-за большей доли меди в составе Cu-Sn.
Напротив, в случае Sn 3d5/2, Sn4+ в основном обнаруживался при 486,7 эВ, что означает, что SnO2 в основном образуется на внешнем, поверхностном слое Cu-Sn спонтанным окислением олова. Более того, пик Sn4+ практически не зависел от плотности тока. Пик же Sn00 при интенсивности 485,3 эВ уменьшался с увеличением плотности тока.
Таким образом, можно предположить, что при плотностях тока выше 3 А/дм2 самый верхний слой покрытия Cu-Sn в основном состоит из Cu2O/SnO2. При плотностях тока ниже 2А/дм2 внешний слой представлен чистым сплавом Cu-Sn, что соответствует рисунку 7, где ярко-белый цвет наблюдался именно при низких плотностях тока.
Рисунок 11 — Спектры РФЭС высокого разрешения для покрытий Cu-Sn, осажденных при плотностях тока от 0,5 до 6 А/дм2 в смешанном растворе.
Коррозионная стойкость покрытия Cu-Sn на стали оценивалась поляризационными испытаниями в 0,1М растворе NaCl. Рисунок 12 демонстрирует, что на ток коррозии явно влияет плотность тока, на которой проводилось осаждение сплава.
Рисунок 12 — Коррозионные кривые покрытия Cu-Sn, осажденного на сталь при разных плотностях тока. Коррозионная среда — 0,1М раствор NaCl. Сплав Cu-Sn, осажденный при плотности тока 1 А/дм2 показал лучшую коррозионную стойкость. Возможно, этому способствовала компактная и однородная поверхность. Также немаловажно, что более высокие плотности тока приводят к дефициту олова в покрытии или к образованию окисленных форм олова, таких как SnO и SnO2, что также способствует ухудшению коррозионной стойкости покрытия.
Более подробно о коррозионной стойкости белой бронзы рассказано в статье.
Бронзирование металла в домашних условиях
Оксидирование и бронзирование металлов
- Уксусно-медной соли (в кристаллах) 5 г;
- Нашатырного спирта 7 г;
- Уксусной кислоты 3 г;
- Воды 85 г.
Медные предметы, подлежащие коричневому оксидированию сильно нагревают на углях, затем погружают их в указанный состав или обмазывают им, после чего покрывают раствором из 1 вес. ч. Воска в 4 вес. ч. терпентинного масла.
- Серноникелевой соли 100 г;
- Бертолетовой соли 200 г;
- Медного купороса 900 г;
- Марганцевокалиевой соли 10 г;
- Воды 5 л.
- Хлористого аммония 30 г;
- Кислой щавелевой соли 10 г;
- Уксусной кислоты 0,25 л.
Очищенные предметы натирают при помощи мягкой щетки или полотняной тряпки этим раствором, пока натираемое место совершенно не высохнет.
Операцию повторяют, пока не получится окраска желаемого оттенка.
В 100 см3 воды растворяют 10 г роданистого аммония, затем прибавляют 10 г нашатырного спирта (уд. в. 0,91) и раствор 3 г медного купороса в 9 см3 воды. Предмет помещают в раствор на 5 часов.
Особенности гальванических белых бронз с цинком.
Как уже упоминалось ранее, состав, структура и свойства белых бронз с цинком и без него отличаются. Для удобства данные, относящиеся к цинксодержащей бронзе приведены в сравнении с безцинковой. На рисунке 13 представлены электронномикроскоопические изображения тонких покрытий белой бронзой с введением цинка и без него. На изображениях, не содержащих цинка, видны элементы размером менее 50 нм. Такие наноструктуры являются результатом введения добавок, которые ингибируют рост кристаллов и способствует измельчению зерна. В результате шероховатость поверхности становится намного меньше, чем длина волны света. Пленки бронзы, содержащие цинк, напротив, имеют гораздо менее заметные наноструктуры. В частности, поверхность кажется покрытой некогерентным слоем, который, если его держать под электронным лучом, быстро меняет форму, что свидетельствует о высоком углеродном загрязнении, которое невозможно удалить с поверхности. Это связано с химической природой добавок, что приводит к большему количеству поверхностных примесей в цинкосодержащих бронзах.
Рисунок 13 —
СЭМ-изображения морфологии поверхности Zn-содержащей белой бронзы (a, c, e, левый столбец, соответственно толщиной 0,5, 1,0 и 1,5 мкм) и белой бронзы без Zn (b, d, f,правый столбец соответственно толщиной 0,5, 1,0 и 1,5 мкм).
Микроизображения поперечных шлифов даны на рисунке 14.
Рисунок 14 —
Микроизображения покрытий толщиной 1,5 мкм: а — Zn-содержащая белая бронза, b — белая бронза, не содержащая цинка. На рисунке 15 приведены результаты рентгено-фазового анализа цинксодержащей белой бронзы. Видны пики подложки α-латуни (черный), β-латуни (зеленый) и интерметаллидов в покрытиях — Cu6Sn5 (желтый) и Cu5Zn8 (синий).
Рисунок 15 — Смоделированные (сплошная красная линия) и экспериментальные (пунктирная черная линия) рентгеновские дифрактограммы: а — цинксодержащих, б — не содержащих цинка бронз. Наличие фазы Cu5Zn8 в цинковой бронзе доказать труднее, так как ее пики сильно накладываются на пики Cu6Sn5 и латунной подложки ((110) на 42,8о β-латуни). Полный анализ структуры дает размер кристаллитов 70 (± 5) нм для бронзы, содержащей цинк, и 50 (± 5) нм для бронзы, не содержащей цинка (изотропное приближение). По результатам РФЭС-анализа было обнаружено, что в цинксодержащей бронзе значительная доля олова на поверхности была металлической, а цинк находился в форме оксидов (Zn0 при 1021,8 эВ, оксид Zn при 1022,1 эВ).
Особенности работы с хромированным покрытием деталей
Во время подготовительный работ и в процессе покраски могут возникать трудности со снятием хрома, который лучше всего затирать специальной машинкой. Ручная же работа потребует усердия и большого запаса свободного времени.
Если вы решили самостоятельно преобразить внешний вид своего авто и сменить надоевшие хромированные детали на красивые угольно-черные, тогда вам следует запастись терпением и качественными материалами. Этот процесс весьма длительный, особенно если вам предстоит самостоятельно снять хром с пластика, но, соблюдая наши рекомендации, вы сможете выполнить эту работу качественно, а эффект продержится долго.