С2Н2 ацетилен. Свойства ацетилена. Получение ацетилена.
Свойства ацетилена.
В качестве горючего газа при кислородной резке наибольшее распространение получил ацетилен, который является химическим соединением углерода с водородом (С2Н2). При нормальных температуре и давлении ацетилен находится в газообразном состоянии.
Химически чистый ацетилен является бесцветным газом со слабым эфирным запахом и слегка сладковатым вкусом. Технический ацетилен, применяемый для кислородной резки, вследствие присутствия в нем некоторых примесей (сероводорода, аммиака, фосфористого водорода и др.) отличается резким неприятным запахом и является вредным для организма человека.
При давлении свыше 2 кг/см2 ацетилен в больших объемах приобретает свойства взрывчатого газа и при соприкосновении с накаленной поверхностью или от электрической искры взрывается, при этом температура достигает 3000°С, а давление увеличивается более чем в 10 раз.
С кислородом и воздухом ацетилен образует взрывоопасные смеси, которые от огня взрываются. Ацетилено — воздушная смесь является взрывоопасной при наличии от 2,3 до 81% ацетилена в воздухе. Еще более опасной является ацетилено — кислородная смесь, которая от огня взрывается при содержании в кислороде от 2,3 до 93% ацетилена, при этом скорость распространения взрывной волны достигает 3000 м/сек, поэтому особенно тщательно нужно следить за плотностью всех ацетиленовых приборов, трубопроводов и пр.
Также читайте: Какие свойства кислорода. Вес 1 м3 кислорода. Вес жидкого кислорода. Способы получения кислорода.
Взрывчатость ацетилена сильно понижается при размещении его в капиллярных (очень тонких) каналах. Этим свойством ацетилена пользуются при наполнении баллонов под давлением — ацетиленовые баллоны заполняют специальной пористой массой.
Реакция ацетилена с ацетоном.
Ацетилен хорошо растворяется во многих жидкостях, особенно в ацетоне. В одном объеме ацетона при 15°С и нормальном давлении растворяется 23 объема ацетилена, а при повышенном давлении — пропорционально больше. Это свойство ацетилена также используют при наполнении баллонов. Растворимость ацетилена в ацетоне в значительной степени зависит от температуры: с повышением температуры растворимость уменьшается, а с понижением резко возрастает.
Способность растворенного ацетилена к взрыву понижается.
Реакция сгорания ацетилена.
Ацетилен при сгорании в смеси с чистым кислородом дает пламя с температурой 3050 — 3150°С, а при сгорании в смеси с воздухом 2350°С.
Полное сгорание ацетилена.
Для полного сгорания 1 м3 ацетилена требуется 2,5 м3 кислорода или 12,5 м3 воздуха.
Ацетилен легче кислорода и воздуха. Удельный вес ацетилена при 0°С и 760 мм рт. ст. 1,17 кг/м3.
При длительном взаимодействии с красной медью и серебром ацетилен дает соединения, которые при нагревании или при сильном ударе взрываются. Поэтому при изготовлении ацетиленовой аппаратуры и арматуры запрещено применение серебряных припоев и красной меди в чистом виде. Допускаются лишь технические медные сплавы, содержащие не более 70% меди.
Получение ацетилена.
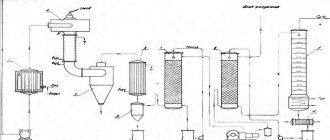
Основным промышленным способом получения ацетилена является разложение карбида кальция водой. Карбид кальция представляет собой химическое соединение кальция с углеродом (СаС2) и является твердым веществом темно-серого или серого цвета.
Технический карбид кальция получается сплавлением негашеной извести с углем (коксом или антрацитом). Шихта, состоящая из смеси угля и извести в определенной пропорции, погружается в электрическую дуговую печь, где под влиянием тепла электрической дуги расплавляется с образованием карбида кальция.
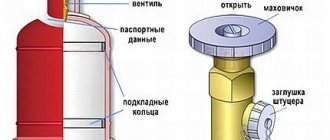
Расплавленный карбид выливают из печи в формы — изложницы, в которых он застывает. Застывший карбид кальция затем дробят, сортируют на куски определенных размеров и упаковывают в специальные барабаны для хранения и транспортировки. Барабаны для упаковки карбида кальция делают из листового железа толщиной не менее 0,5—0,6 мм с герметически закрывающейся крышкой. На цилиндрической поверхности барабанов для повышения их прочности накатаны гофры. Барабан вмещает 50— 130 кг карбида кальция.
Карбидные барабаны следует открывать очень осторожно, так как по тем или иным причинам внутрь барабана может проникнуть влага и образоваться взрывоопасная ацетилено-воздушная смесь. Лучше всего покрыть крышку барабана слоем тавота и снимать ее специальным ножом. Ни в коем случае нельзя прибегать к ударам молотка.
Категорически запрещается при раскупорке карбидных барабанов применять пламя или же вырубать крышку барабана зубилом.
Разложение ацетилена.
При действии воды карбид кальция разлагается, образуя ацетилен и гашеную известь. Реакция протекает по уравнению
CaC2 + 2H2O = C2H2 + Ca(OH)2
и сопровождается значительным выделением тепла.
Карбид кальция при соприкосновении с атмосферным воздухом, содержащим пары воды, разлагается с выделением ацетилена. Из 1 кг карбида кальция обычно получается от 230 до 300 л ацетилена.
Для разложения 1 кг карбида кальция теоретически требуется 0,56 л воды. Реакция разложения карбида протекает с выделением большого количества тепла, поэтому недостаток воды может привести к значительному перегреву и даже воспламенению ацетилена в месте разложения карбида. Во избежание этого процесс разложения карбида ведут всегда с избыточным количеством воды, которая используется для охлаждения. Практически на 1 кг карбида кальция берется от 5 до 20 л воды.
Статья оказалась полезной?! Поделись с друзьями в социальных сетях!!!
Ацетилен
Подробности Категория:
АЦЕТИЛЕН
, С2Н2. Молекулярный вес 26. Ацетилен по своим физическим свойствам представляет собой бесцветный газ, в чистом состоянии обладающий слабым своеобразным запахом; несколько легче воздуха (удельный вес 0,9056). 1 литр ацетилена весит около 1,17 г. Растворим в воде, в спирте и очень легко, под давлением, в ацетоне; 1 объем ацетона растворяет под давлением 12 atm около 300 объемов ацетилена; жидкость при этом сильно увеличивается в объеме. Ацетилен при 25° и 94 atm сгущается в бесцветную легко подвижную жидкость, кипящую под атмосферным давлением при —83°,8, удельный вес 0,451; критическая температура +37°, критическое давление 68 atm. При дальнейшем охлаждении жидкого ацетилена он застывает в белую снегообразную массу. Так как температура плавления лежит очень близко к температуре кипения, то такой твердый ацетилен испаряется, не плавясь, — возгоняется.
Химически ацетилен представляет собой непредельный углеводород, являющийся первым членом гомологического ряда аналогичных углеводородов. Все они характеризуются присутствием в частице так называемой тройной связи между углеродными атомами и имеют общую формулу СnН2n-2 (n= 2, 3, 4, …).
Строение ацетилена изображается формулой СН : СН
. Согласно представлениям, развиваемым в органической химии, такого рода соединения являются менее прочными, чем соединения предельные, не содержащие кратных связей (двойной или, как в ацетилене, тройной). Эти соединения являются эндотермическими. Образование ацетилена может быть изображено следующим уравнением: 2С + 2Н = С2Н2 — 61 cal. Ацетилен, подобно всем эндотермическим соединениям, может при подходящих условиях разлагаться со взрывом. Однако при обыкновенном давлении он безопасен и получает свойства взрывчатого вещества лишь при повышении давления свыше 2 atm или в жидком виде. Смеси ацетилена с инертными газами или его растворы значительно более безопасны. Ацетилен горит светящимся и коптящим пламенем на воздухе. При полном горении 1 объем ацетилена дает 2 объема двуокиси углерода и 1 объем водяных паров. Для полного сгорания 1 объема ацетилена теоретически требуется 2,5 объема кислорода или 12,5 объема воздуха. Молекулярная теплота горения ацетилена 312,9 cal. при постоянном давлении. 1 л ацетилена при 0° и 760 мм имеет теплотворную способность 14100 cal. Температура светящегося пламени около 1900°; температура горения смеси 0,6 объема ацетилена и 1 объема кислорода (обычное соотношение при автогенной сварке) около 2400°; температура вспышки смесей ацетилена с воздухом и кислородом лежит в пределах 400—500°. При температуре 650—800° ацетилен отчасти распадается на элементы, отчасти полимеризуется с образованием жидких и твердых углеводородов. При температуре выше 1500° образуются этилен и этан.
Смеси ацетилена с кислородом и воздухом крайне взрывчатые. Смеси с воздухом, содержащие больше 5 и меньше 80% ацетилена, взрывают от пламени, электрической искры и т. п. Как непредельное соединение ацетилен характеризуется способностью к реакциям присоединения. Галоиды (хлор, бром) энергично взаимодействуют с ацетиленом, в виду чего реакцию приходится вести в растворах, с образованием галоидопроизводных углеводородов: этана и этилена. Йодистый и бромистый водород также прямо присоединяются к ацетилену. Присоединение хлорноватистой кислоты (НСlO) даже в водных растворах может сопровождаться взрывом.
Разведенные водные растворы гипохлоритов (солей хлорноватистой кислоты, например, белильная известь) почти не действуют на ацетилен, концентрированные — реагируют бурно. Сухая белильная известь на холоде действует лишь на примеси технического ацетилена, чем и пользуются для его очистки, но всегда с добавкой избытка щелочей (чтобы избежать возможности образования взрывчатых соединений). Ацетилен может в присутствии катализаторов (Ni) присоединять водород, образуя этилен, этан и ряд жидких углеводородов. Азотная кислота окисляет ацетилен; при этом частью идет присоединение воды и нитрация; некоторые из получающихся продуктов взрывчатые. Щелочные растворы перманганата калия окисляют ацетилен до угольного ангидрида, частью до муравьиной и щавелевой кислоты. При действии на ацетилен хромовой кислоты образуются ацетальдегид и уксусная кислота. Водные растворы хромовой кислоты на ацетилен не действуют, чем можно пользоваться для очистки технического ацетилена. При пропускании ацетилена в смеси с аммиаком над окисью алюминия получаются при температуре 300—400° пирролы и пиридиновые основания (Чичибабин). При пропускании ацетилена над пиритом (серный колчедан) образуются тиофен и его гомологи (Штейнкопф). Ацетилен присоединяет элементы воды с образованием ацетальдегида при пропускании его в серную кислоту, содержащую соли окиси ртути (Кучеров). Характерна для ацетилена его способность образовывать нерастворимые в воде взрывчатые осадки производных меди, серебра и некоторых других металлов. Красный осадок ацетиленистой меди (состава ССu2, иногда ССu2∙Н2O) получается при пропускании ацетилена через растворы (нейтральные) медных солей или через аммиачный раствор окиси меди. В сухом виде осадок взрывается от ничтожных причин. Аналогично образуются ацетилиды серебра и ртути. Влажный ацетилен в присутствии аммиака (технический ацетилен) действует и на металлическую медь. На соли железа, никеля, кобальта, свинца, кадмия, платины, цинка и олова ацетилен не действует. Металлические производные меди, серебра и ртути разлагаются кислотами, выделяя обратно ацетилен. Производным ацетилена является и т. н. карбид кальция СаС2; этот ацетилид кальция легко разлагается уже водой с образованием ацетилена и гидрата окиси кальция. Карбид получается сплавлением в электрической печи (~ 3000°) извести и угля. Эта реакция воспроизводится теперь в большом масштабе технически, и этот карбид служит источником технического ацетилена.
Синтетически ацетилен был получен впервые Бертело; он помещал вольтову дугу, образованную между угольными электродами, в атмосферу водорода. Ацетилен часто образуется при пирогенных процессах из более сложных соединений. Технически ацетилен теперь получают, как выше сказано, разложением карбида кальция водой.
С момента появления карбида в 1895 г. как массового продукта ацетилену предсказывали блестящее будущее. Считали, что он сможет вытеснить светильный газ из обихода. Это не оправдалось. Причины лежали в неприятных свойствах ацетилена: его взрывчатости, способности давать взрывчатые соединения с медью как материалом арматуры, отвратительном запахе и ядовитости примесей технического ацетилена Кроме того, устройство горелок требовало особой их конструкции. Ацетилен горит блестящим и не коптящим пламенем лишь в том случае, если он поступает в воздух под некоторым давлением и, если устройство насадок у горелок обеспечивает возможность достаточного смешения с воздухом, а также если в такой насадке не образуются продукты распада (графит) или полимеризации ацетилена под влиянием высокой температуры. Эта проблема разрешена, но ацетиленовым освещением пользуются лишь для установок малого размера или переносного типа. Высокая температура и малый объем ацетиленокислородного пламени обусловили широкое применение ацетилена для т. н. автогенной сварки. Перед мировой войной в Германии не менее 30—40% карбида шло на эту отрасль применения ацетилена.
В собственно химической промышленности широко пропагандировались и получили распространение некоторые галоидопроизводные, получаемые из ацетилена и хлора. Это — жидкости, превосходно растворяющие жиры, смолы и т. п. вещества, негорючие, с малой теплотой парообразования; они с успехом заменяют огнеопасные бензины и эфир для целей экстракции упомянутых веществ. Проще всего получить первоначально тетрахлорэтилен, обладающий, однако, некоторыми практически неудобными свойствами (реагирует со щелочами и действует в присутствии воды на железо); поэтому нагреванием с известковым молоком этот продукт превращают в трихлорэтилен С2НСl3 — жидкость с температурой кипения 85°, индифферентной даже в присутствии воды по отношению к железу, меди, свинцу, цинку и олову. Довоенное перепроизводство хлора нашло в этих продуктах новый способ реализации на рынке избыточного хлора. Вздорожание продуктов сухой перегонки дерева, в частности уксусной кислоты, необходимой для синтеза индиго (через фенилглицин из анилина и хлоруксусной кислоты), вызвало применение трихлорэтилена для замены уксусной кислоты в этой отрасли синтеза красителей. Нагреванием трихлорэтилена с алкоголятом натрия получался дихлорвиниловый эфир по схеме: C2HCl3 + NaOC2H5 = NaCl + C2HCl2OC2H5. Нагреванием с водой этого последнего получался хлоруксусный эфир: С2НСl2ОС2Н5 + H2O = HCl + СlСН2СООС2Н5.
В послевоенные годы начинает приобретать все большее значение следующий цикл реакций. Пропускание ацетилена в горячую 6 %-ную серную кислоту, содержащую соли окиси ртути (реакция Кучерова), дает уксусный альдегид по реакции: С2Н2 + Н2О = СН3∙СНО. Альдегид можно окислить кислородом воздуха, растворив его в готовой уксусной кислоте; окисление идет в присутствии небольших количеств марганцовых солей. Получается синтетическая уксусная кислота СН3∙СНО + О = СН3СООН. Можно конденсировать две частицы альдегида в одну частицу уксусного эфира (реакция Тищенко) в присутствии алкоголята алюминия: 2 СН3∙СНО = СН3СООС2Н5. Как видно, все эти реакции, в сущности, нуждаются лишь в дешевом ацетилене, ибо остальные исходные материалы — вода и кислород воздуха — ничего не стоят, катализаторы же регенерируются в процессе работы. Вопрос возможности конкуренции уксусной кислоты, полученной этим способом, с уксусной кислотой, получаемой при сухой перегонке дерева, — это вопрос дешевизны ацетилена или, в конечном счете, вопрос о дешевой электрической энергии для получения карбида. Во всяком случае получение уксусно-этилового эфира таким путем уже сейчас практикуется в техническом масштабе и вполне рентабельно.
Источник: Мартенс. Техническая энциклопедия. Том 1 — 1927 г.
- < Назад
- Вперёд >