На свете известно очень много разных химических соединений: порядка сотни миллионов. И все они, как люди, индивидуальны. Нельзя найти два вещества, у которых совпадали бы химические и физические свойства при разном составе.
Одними из интереснейших неорганических веществ, существующих на белом свете, являются карбиды. В данной статье мы обсудим их строение, физические и химические свойства, применение и разберём тонкости их получения. Но для начала немного об истории открытия.
Карбидный класс
Карбидный класс — сталь с высоким содержанием углерода и кар-бидообразующих элементов; в литом состоянии в ст-уктуре такой стали имеется карбидная эвтектика, в деформированном состоянии — первичные и вторичные карбиды. Типичным примером стали карбидного класса г. ожет служить быстрорежущая сталь.
Сталь карбидного класса применяется для изготовления инструмента. Вследствие высокого содержания углерода и очень большого количества карбидообразующих элементов в ее структуре присутствует много карбидов. В литом состоянии структура этой стали содержит карбидную эвтектику — ледебурит. Основная структура стали карбидного класса зависит от степени легированности аусте-нита, которая изменяется в зависимости от температуры нагрева. При низкой температуре нагрева, как только перейдена критическая точка, растворение карбидов замедляется, структура после охлаждения на воздухе получается сорбитообразной с большим количеством избыточных карбидов. Более высокий нагрев ведет к растворению карибдов и получению после охлаждения на воздухе мартенситной структуры.
Стали карбидного класса в своем большинстве относятся к инструментальным сталям.
К карбидному классу относятся стали Х12М, Р9, Р18 и др., содержащие большое количество углерода и карби-дообразующих элементов Cr, W, V и др. Для этого класса характерным является именно наличие карбидов, структура же основного фона может быть в зависимости от состава и температуры нагрева перлитной, мартенситной и аустенитной. Эти стали обладают высокой твердостью и износостойкостью. Применяются для изготовления режущего инструмента и штампов, работающих в тяжелых условиях.
Из стали карбидного класса изготовляют главным образом режущие инструменты.
Структура стали карбидного класса ( ледебурит) в зоне термического влияния.
Структура сталей карбидного класса в кованом и отожженном состоянии состоит кз сорбита или зернистого перлита, вторичных и ледебуритных карбидов ( см. фиг. Стали ледебуритного класса, подобно сталям перлитного класса, способны к фазовым превращениям и, следовательно, их можно подвергать закалке на мартенсит. Наличие в их структуре большого количества карбидов вносит некоторые особенности в обычную схему закалки. Эти особенности мы сейчас и рассмотрим.
| Структура наплавленного металла при сварке стали перлитного класса. |
К сталям карбидного класса относят стали мартенситного или аустенит-ного класса с карбидообразующими элементами ( хром, вольфрам и др.), благодаря чему в структуре металла наряду с мартенситом или аусте-нитом содержится значительное количество карбидов.
| Микроструктура износостойкого высокохромистого чугуна ( х 250.| Морфология включений графита в чугунных отливках. а — не подвергнутой модифицированию. модифицированных УДП в количестве 0 05 % мае.. б — TiN SiC Ni, e — SiC Сг. |
В сталях карбидного класса добавки УДП позволяют получать структуру, напоминающую булатную сталь. Прочность такой стали увеличивается на 15 20 %, а пластичность и ударная вязкость возрастают в 1 5 2 раза, что позволяет отливать кузнечно-прессовый инструмент с литой гравюрой, не уступающий по свойствам инструменту из кованого металла.
Наиболее типичными сталями карбидного класса являются быстрорежущие. Поэтому особенности термической обработки сталей карбидного класса мы и рассмотрим на примере быстрорежущих сталей, тем более, что они имеют и большой практический интерес.
Если легированную сталь карбидного класса подвергнуть ковке, то включения карбидов равномерно распределяются в основной металлической массе в виде глобулей. Сталь карбидного класса применяют главным образом для изготовления инструментов.
При ковке стали карбидного класса включения карбидов равномерно распределяются в основной металлической массе в виде глобу-лей.
Для поковок из стали карбидного класса, у которой требуется размельчение карбидов и их равномерное распределение по сечению, необходима большая уковка и чередование операций протяжки и осадки.
Получение
Как ранее было отмечено, карбид кальция активно применяется при получении самых различных материалов. Именно поэтому процесс получения карбида кальция постоянно совершенствовался. К особенностям применяемых технологий можно отнести нижеприведенные моменты:
- В качестве сырья применяется негашеная известь. В большинстве случаев вещество получается из извести, но в домашних условиях провести подобную процедуру сложно.
- Известь смешивается с измельченном коксом для получения однородной массы.
- В промышленности карбид кальция получают по схеме, которая предусматривает нагрев вещества до высокой температуры. Для этого применяются электронные печи. Рекомендуемая температура плавления составляет 1900 ⁰С.
- После нагрева вещества до столь высокой температуры оно переходит в жидкое состояние. Для работы подготавливаются специальные формы.
При рассмотрении того, как из углерода получить карбид кальция отметим, что по установленным стандартам в состав должно входить не менее 80% основного вещества. На долю примесей должно приходится не более 25%, в число которых также входит углерод. Производство оксида кальция также приводит к выделению тепловой энергии, что стоит учитывать.
Ionic carbides
Карбид кальция: свойства и применение. получение ацетилена
Salt-like, ionic carbides are formed by the following metals:
- group one metals (the alkali metals);
- group two metals (the alkaline earths);
- group three metals (scandium, yttrium, and lanthanum);
- group 11 metals (copper, silver, and gold);
- group 12 metals (zinc, cadmium, and mercury);
- only aluminum from group 13, (gallium, indium and thallium do not appear to form carbides);
- lanthanides, when forming MC2 and M2C3 carbides (where M is the metal);
- actinides, when forming MC2 and M2C3 carbides.
Most commonly, they are salts of C22− and are called acetylides, ethynides, acetylenediides, or (rarely) percarbides. Some ionic carbides contain other anionic species, such as:
- C4−, sometimes called methanides (or methides) because they hydrolyze to give methane gas;
- C34− ion, sometimes called sesquicarbides, which hydrolyze to give methylacetylene.
The naming of ionic carbides is not consistent and can be quite confusing.
Acetylides
Acetylides contain the polyatomic ion C22−, in which there is a triple bond between the two carbon atoms (similar to acetylene). Examples are carbides of the alkali metals (such as Na2C2), some alkaline earths (such as CaC2) and lanthanoids (such as LaC2).
The C-C bond distance ranges from 109.2 picometers (pm) in CaC2 (similar to acetylene), to 130.3 pm in LaC2 and 134pm in UC2.
Methanides
Methanides contain the monatomic ion C4−. Examples of methanides are Be2C and Al4C3.
The C4− ion is a very strong base and will combine with four protons to form methane. The reaction may be written as follows:
C4− + 4H+ → CH4
Methanides commonly react with water to form methane, but reactions with other substances are also common.
Sesquicarbides
The polyatomic ion C34− is found in, for instance, Li4C3 and Mg2C3. The ion is linear and isoelectronic with CO2. The C-C distance in Mg2C3 is 133.2 pm. Hydrolysis of Mg2C3 yields methylacetylene (CH3CCH), which was the first indication that it may contain C34−.
Применение в промышленности
Карбид кальция является важным соединением для получения ацетилена, газа, который используется при кислородной сварке и обработке металлов
. При горении с кислородом ацетилен способен достигать 3150 градусов Цельсия. Это позволяет работать с тугоплавкими металлами, требующими температуру вдвое большую,чем температура плавления самого металла.
Карбид бора используется как огнеупорный материал, поскольку температура плавления такого соединения выше 2400 градусов. При этом он же встречается в бронежилетах,так как способен защитить не только от пуль и осколков, но и от радиации. Для покрытия промышленного и строительного инструмента используют карбид титана. Его прочность позволяет повысить износостойкость деталей и обрабатывать даже самые прочные материалы.
Covalent carbides
Карбид кальция
There are only two carbides that are considered completely covalent; they are formed with the two elements that are most similar to carbon in size and electronegativity, boron (B) and silicon (Si). Silicon carbide (SiC) is known as carborundum and is prepared by the reduction of silicon dioxide (SiO2) with elemental carbon in an electric furnace. This material, like diamond, is extremely hard and is used industrially as an abrasive. It is chemically inert and has a diamond structure in which each silicon atom and each carbon atom are surrounded tetrahedrally by four atoms of the other type. Boron carbide (B4C) has similar properties. It is also extremely hard and inert. It is prepared by the reduction of boron oxide (B2O3) with carbon in an electric furnace. In the structure of B4C, the boron atoms occur in icosahedral groups of 12, and the carbon atoms occur in linear chains of three. Another boron carbide (BC3), which has a graphitelike structure, is produced from the reaction of benzene (C6H6) and boron trichloride (BCl3) at 800 °C (1,500 °F).
References
- Brown Jr., Theodore L., H. Eugene LeMay, Bruce Edward Bursten, and Julia R. Burdge. 2002. Chemistry: The Central Science
. 9th ed. Upper Saddle River, NJ: Prentice Hall. - Chang, Raymond. 2006. Chemistry
. 9th ed. New York, NY: McGraw-Hill Science/Engineering/Math. - Cotton, F. Albert, and Geoffrey Wilkinson. 1980. Advanced Inorganic Chemistry
. 4th ed. New York, NY: Wiley. ISBN 0-471-02775-8. - Ettmayer, Peter, and Walter Lengauer. 1994. Carbides: transition metal solid state chemistry. In Encyclopedia of Inorganic Chemistry
. Editor in chief R. Bruce King. Chichester, UK: Wiley. ISBN 0-471-93620-0. - Greenwood, N.N., and A. Earnshaw. 1998. Chemistry of the Elements
. 2nd ed. Oxford, U.K.; Burlington, MA: Butterworth-Heinemann, Elsevier Science. ISBN 0750633654. Online version available here Retrieved January 4, 2008.
Константан сплав — свойства и применение
Карбидный ил
Разлив карбидного ила по территории, где установлен генератор, а также слив его в канализацию или в водоемы неочищенных сточных вод категорически запрещается. В иле содержится растворимый в воде и адсорбированный на поверхности гашеной извести ацетилен, который постепенно выделяется в атмосферу. Кроме того, в иле всегда содержатся в некотором количестве куски неразложившегося карбида кальция, которые под воздействием воды, содержащейся в иле, атмосферных осадков и влаги воздуха разлагаются, выделяя добавочное количество ацетилена. Выделенного ацетилена может оказаться достаточно для образования взрывоопасной смеси с воздухом. Эта смесь может загореться на месте слива ила, а также, занесенная ветром, в производственных или жилых помещениях. Не менее опасно попадание ацетилена в воздушные компрессоры, в кислородные установки и др. В закрытых канализационных магистралях взрыв ацетилено-воздушной смеси может привести к значительным разрушениям.
Отвод карбидного ила в общую канализацию и водоемы сточных вод без применения специальных очистных устройств не допускается.
К карбидному илу иногда добавляют различные щелочеустойчивые пигменты ( краплак, ультрамарин) и, таким образом, не только белят, но и красят стены и потолки в различные цвета.
Для побелки карбидный ил применяется в виде разбавленного известкового молока. Побелка известью возможна как по затвердевшей, так и по сырой штукатурке.
Можно применять карбидный ил для заливки подпольных пространств и каналов в рабочих помещениях и лабораториях с целью удаления ртути и ее паров. Заливая полы кашицеобразным карбидным илом и удаляя его с последующей заливкой новым слоем ила толщиной в 10 — 15 см на продолжительный срок, можно добиться значительного снижения концентрации паров ртути.
При удалении карбидного ила из иловых ям вакуум-цистернами должен быть обеспечен свободный подъезд цистерн к отстойникам только задним ходом.
Для удаления карбидного ила из отстойников должны быть предусмотрены стационарные насосы. Допускается применение вакуумных автоцистерн, приспособленных для перекачки и транспортировки карбидного ила.
| Передвижная кисло-родораздаточная станция ( Московский филиал Оргэнергостроя.| Объем илового отстойника. |
Для извлечения карбидного ила целесообразно применение водоструйного эжектора или автокрана с грейфером.
Учитывая способность карбидного ила удерживать ацетилен, следует перед ремонтом аппаратов с применением нагрева их частей тщательно и полностью удалять ил с поверхностей газообразова-телей или другой аппаратуры, во избежание опасности образования взрывчатых ацетилено-воздушных смесей.
Время отстаивания карбидного ила зависит от количества воды, затраченной на разложение карбида кальция. В воде, полученной при отстаивании ила, содержится растворенный ацетилен; кроме того, часть ацетилена адсорбируется мелкодисперсными частицами ила. При хранении ила количество содержащегося в нем ацетилена постепенно уменьшается. Потери ацетилена с карбидным илом являются основными при эксплуатации генераторов.
Карбид кальция и карбидный ил могут вызвать ожоги кожи и опасные ожоги глаз.
В случае применения карбидного ила с содержанием 10 % Са ( ОН) 2 продолжительность гидролиза по сравнению с гидролизом в чистой воде увеличивается незначительно. При применении карбидного ила с содержанием 20 % Са ( ОН) 2 при 17 С процесс гидро лиза резко замедляется вследствие заиливания кусков.
Подлежащую фильтрованию суспензию карбидного ила заливали в напорный бак, снабженный рубашкой для подогрева.
В случае перевозки карбидного ила автоцистерна Т-158 не должна комплектоваться взрывоопасным электросигнальным устройством для оповещения окончания заполнения. Наблюдать за наполнением можно через смотровое стекло, имеющееся в торцовом днище цистерны.
Химические свойства
Немаловажное значение имеют и химические свойства. Они также учитываются при применении материала. К основным характеристикам можно отнести следующие качества:
- Карбид кальция характеризуется тем, что хорошо впитывает влагу. Стоит учитывать, подобная процедура проявляется яркой химической реакцией, связанной с разложением вещества.
- При работе с рассматриваемым материалом стоит учитывать, что образующаяся пыль оказывает раздражительный эффект на слизистые органы. Кроме этого, подобная реакция может проявится при попадании кристаллов или пыли на поверхность кожи. Именно поэтому при работе с рассматриваемым соединением следует использовать респиратор и некоторые другие средства защиты.
- Кристаллы активное реагируют на воздействие других веществ зачастую только при нагреве. При этом может образоваться карбонат кальция.
- В некоторых случаях проводится соединение кристаллического вещества с азотом, в результате чего получается цианамид кальция.
- При нагреве может проходить реакция с мышьяком и хлором, а также фосфором.
Карбонат кальция
Считается, что наиболее важным химическим качеством является податливость к разложению при воздействии воды.
Применение карбида кальция
Как ранее было отмечено, карбид кальция встречается в самых различных областях промышленности, зачастую поставляют для проведения промышленного синтеза. Свойства карбида кальция и реакция, протекающая при его соединении с различными веществами, определяют использование вещества в нижеприведенных случаях:
- Многие синтетически компоненты, входящих в состав современных материалов, производят на основе рассматриваемого компонента.
- Применяется для получения цианамида кальция. Подобный компонент используется для получения различных химических удобрений. Именно поэтому сырье применяется для регулирования скорости роста растений.
- Цианамид кальция также получают при соединении вещества с азотом.
- В некоторых случаях проводится восстановление металлов щелочной группы.
- Можно использовать рассматриваемое соединение в процессе газовой сварки.
При рассмотрении карбида кальция и области применения стоит учитывать, что подобное вещество чаще всего применяют для получения ацетилена. Подобный синтез карбида кальция разработал немецкий ученый. Среди особенностей подобного способа применения отметим следующие моменты:
- Ацетилен из карбида получают при оказании воздействия водой на используемое сырье.
- В результате прохождения химической реакции образуется требующийся газ, гашеная известь выпадает в осадок.
- Стоит учитывать, что при смешивании компонентов выделяется большое количество тепла. Поэтому работа должна проводится с учетом техники безопасности.
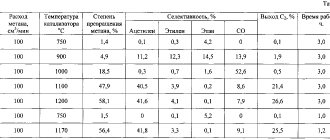
- В зависимости от вида применяемой технологии переработки сырья с 1 килограмма выходит около 290 литров газа.
- Скорость протекания процедуры зависит от чистоты применяемого сырья, температуры и количества воды.
Получение ацетилена из карбида кальция
Как показывает практика, при использовании чистого карбида на протекание химической реакции отводится около 20 литров волы на 1 килограмм сырья. Подобное количество воды требуется для того чтобы снизить температуру реакции, за счет чего обеспечиваются оптимальные условия для работы.
Физические свойства
При выборе практически любого материала следует уделять больше всего внимания физическим свойствам. У рассматриваемого они следующие:
- Соединение имеет кристаллическую структуру.
- Показатель температуры плавления составляет 2300 °С. Стоит учитывать, что подобная цифра свойственна только чистому составу. Добавление в состав различных примесей приводит к тому, что температура плавления существенно падает.
Чистый карбид кальция
Стоит учитывать, что карбид кальция в большинстве случаев находится в твердом состоянии. Кроме этого, цвет может варьироваться от серого до коричневого цвета. Физические свойства карбида кальция определяют его широкое применение в самых различных отраслях промышленности.
Твердость.
Процесс абразивной обработки можно сравнить с процессом обтесывания (зубилом, долотом, стамеской), поскольку материал удаляется с обрабатываемого изделия силовым воздействием острых выступов абразива. Поэтому твердость абразива – очень важный параметр. Германский минералог Ф.Моос установил первую шкалу относительной твердости различных минералов в 1820. По шкале Мооса твердость минералов оценивается значениями от 1 до 10 относительно 10 эталонов, в том числе талька (1), кварца (7) и алмаза (10). Шкала Мооса неравномерна, так что, например, изменение твердости при переходе от эталона 9 к эталону 10 больше, чем при переходе от эталона 1 к эталону 9.
При оценке искусственных абразивов возникла необходимость расширить шкалу Мооса. Р.Риджуэй добавил несколько чисел к верхнему краю шкалы и изменил положение некоторых верхних чисел Мооса. К.Вудделл измерил степень, с какой различные минералы сопротивляются царапанью алмазом в контролируемых условиях и ввел соразмерные числа выше числа Мооса 9 (корунд). Числа твердости по Кнупу определяются по размеру отпечатка, создаваемому при вдавливании в материал алмазной пирамиды под воздействием определенной нагрузки (см. табл.).
Таблица — Различные шкалы твердости
| РАЗЛИЧНЫЕ ШКАЛЫ ТВЕРДОСТИ | ||||
| Шкала твердости | ||||
| Материал | Мооса | Риджуэя | Вудделла | Кнупа |
| Песок | — | 7 | — | 475 |
| Ортоклаз | 6 | 6 | — | 560 |
| Кварц | 7 | 8 | 7 | 820 |
| Плавленый оксид циркония | 7,5 | 11 | — | 1160 |
| Топаз | 8 | 9 | — | 1250 |
| Гранат | 7–7,5 | 10 | — | 1360 |
| Корунд | 9 | — | 9 | 1635 |
| Плавленый глинозем | 9+ | 12 | 10–11 | 2000 |
| Карбид титана | — | — | — | 2300 |
| Карбид кремния | 9+ | 13 | 13,4–14 | 2450 |
| Карбид бора | 9+ | 14 | 19,7 | 2750 |
| Нитрид кремния | — | — | — | 3000 |
| Кубический нитрид бора | 9+ | — | — | 4700 |
| Алмаз | 10 | 15 | 40–42 | 8000–9000 |
Состав и виды карбидов
Карбиды не являются отдельным веществом. Это соединение углерода с металлами и неметаллами. Причем, следует учитывать, что углерод должен обладать большей электроотрицательностью в получаемом веществе по сравнению с другими используемыми элементами. Это дает возможность избежать производства галогенов, оксидов и других углеродных соединений.
На сегодняшний день различают три вида карбида, состав которых отличен друг от друга:
- Ковалентные соединения. К данному виду относят два элемента — кремний и бром. Это соединения с прочной межатомной связью, что обеспечивает высокую температуру плавления и химическую инертность. Окисление веществ данной группы возможно только при их нагреве свыше 1000 градусов Цельсия. Твердость вещества с бромом настолько высока, что способна конкурировать даже с алмазами. Вещество с кремнием менее прочное, но 8 баллов по шкале Мооса имеет. При этом растворить данное вещество возможно только в царской водке или с помощью концентрированной азотной или плавиковой кислоты.
- Ионные соединения или солеобразные. Вещества данной группы образуются с помощью металлов 1 и 2 группы таблицы Менделеева, а также алюминием. Данные соединения характеризуются высокой температурой плавления. Карбиды ионного вида распадаются под воздействием воды и кислот. При протекании реакции выделяется углеводород и остается гидроксид металла.
- Ионно-ковалентно-металлические или металлоподобные соединения. Образуются с помощью металлов с 4 по 8 группу, а также кобальтом, никелем и железом. Отличительная особенность металлоподобных веществ — это высокая прочность и температура плавления. Данный вид соединений делится на два типа:
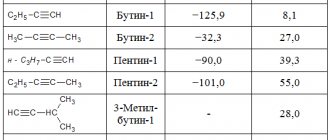
- Ацетилениды — при гидролизе образуют этин или ацетилен. Карбид кальция относится к данному типу соединений.
- Метаниды — при вступлении в реакцию с водой или разбавленными кислотами образуют метан. Чаще бесцветны. Сюда относят карбид алюминия, магния, бериллия.
Intermediate transition metal carbides
In these carbides, the transition metal ion is smaller than the critical 135 pm, and the structures are not interstitial but are more complex. Multiple stoichiometries are common. For example, iron forms a number of carbides: Fe3C, Fe7C3, and Fe2C. The best-known of these is cementite (Fe3C), which is present in steels.
These carbides are more reactive than the interstitial carbides. For example, the carbides of Cr, Mn, Fe, Co, and Ni are all hydrolyzed by dilute acids and sometimes by water, to give a mixture of hydrogen and hydrocarbons. These compounds share features with both the inert interstitials and the more reactive, salt-like carbides.
Кремнезем.
Диоксид кремния SiO2 используется в различных видах (кристаллический, стеклообразный) для придания изделиям формы и шлифования. Хотя разные виды кремнезема химически идентичны, они широко различаются по физическому состоянию, и поэтому каждый из них находит свое специфическое применение.
Диатомит, инфузорная земля, кизельгур и триполит состоят из кремнистых остатков окаменевших диатомовых водорослей. Они используются как мягкие абразивы в качестве компонентов полировальных порошков и паст, например пасты для чистки серебра.
Рухляк и трепел являются продуктами распада кремнистых известняков. Они также используются как компоненты чистящих и полировальных порошков и паст.
Дробленый кварц, кварцит, кремень, кремнистый сланец, песок и песчаник применяются в виде зерен как абразивы в обычной наждачной бумаге, а также для пескоструйной обработки и в чистящих пастах.
Недробленый песок с высоким содержанием кварца используется для пескоструйной обработки, а также для пилки и шлифовки мягкого камня, например мрамора.
Транспортировка и хранение
Порошок карбида кальция при воздействии влаги практически моментально разлагается. При этом образуется ацетилен, который при большой концентрации горюч и взрывоопасный. Именно поэтому нужно уделять довольно много внимания хранению карбида кальция, для чего часто применяют бидоны и специальные барабаны. К другим особенностям хранения отнесем следующие моменты:
- Выделяющийся ацетилен легче воздуха, поэтому скапливается вверху. Стоит учитывать, что он обладает наркотическими действиями, может самовоспламеняться.
- При производстве большого объема вещества особое внимание уделяется технике безопасности. Для фасовки применяются специальные упаковки.
- Для открытия упаковки следует использовать инструменты, которые не становятся причиной образования искр.
- Если вещество попадает на кожу или слизистую оболочку, то его нужно сразу удалить. При этом пострадавшая поверхность обрабатывается специальным кремом или другим защитно-заживляющим веществом.
- По установленным правилам, транспортировка может проводится исключительно при применении крытого транспортного средства. При этом проводить доставку по воздуху запрещается.
Контейнер для транспортировки
Установленные правила также запрещают хранить карбид кальция вместе с другими химическими веществами и источниками тепла. Это связано с тем, что образующиеся газы могут вступать в химическую реакцию с другими химическими веществами и возгораться.
Техника безопасности
Карбид для сварки относится к классу взрывоопасных веществ. Безопасное применение карбида обеспечивается учетом ряда условий:
- Ацетилен является легковоспламеняющимся газом, а сам сухой карбид также взрывоопасен, поэтому возле места проведения работ не должно быть источников открытого огня, даже таких незначительных, как зажигалки и зажженные сигареты.
- Запрещено использование карбида в гранулах до 2 мм или карбидной пыли, так как она растворяется очень быстро, что приводит к выделению большого количества газа. Из-за этого в генераторе образуется сверхвысокое давление и может произойти взрыв.
- Запрещена работа болгаркой или электросварочным аппаратом вблизи газосварочных работ и мест установки карбидных барабанов.
- Вещество должно храниться в сухом и герметичном месте, в котором нет водопроводов, канализационных труб и, тем более, газового оборудования.
- Карбидная пыль при попадании вызывает раздражение кожи, глаз, слизистых оболочек. Работа с этим веществом должна проходить с применением средств индивидуальной защиты – очков, перчаток и респиратора.
- При попадании карбида на кожу или в глаза его необходимо промыть большим количеством теплой воды, а затем аккуратно удалить остатки карбида пинцетом или влажным тампоном.
- При работе с карбидом в мастерской все сварочное оборудование должно быть размещено в отдельных частях помещения, система вентиляции помещения должна обеспечивать отвод горючих газов, а помещение должно быть освобождено от горючих материалов.
- Ацетиленовые генераторы запрещено устанавливать в подвальных помещениях и жилых зданиях.
- Перед запуском генератор следует осмотреть на предмет отсутствия видимых трещин и вмятин корпуса.
- Во время проведения работ генератор должен оставаться в вертикальном положении, манометр должен быть исправен и хорошо виден сварщику или его помощнику.
- По окончании работы оставшийся в генераторе раствор карбида должен быть выработан целиком, а образовавшаяся известь утилизирована.
- Повторное использование мокрых кусков карбида не допускается;
- Запрещено вскрывать генератор под давлением (во время продолжающейся реакции).
- Баллоны для ацетилена хранятся и перевозятся со специальными предохранительными колпаками на клапанах.
Если имеется необходимость в регулярном использовании оборудования для газовой сварки и резки, лучше купить профессиональное оборудование, изготовленное на промышленном предприятии. Применение самодельных генераторов чревато получением тяжелых травм и угрозой для жизни.
Как это может быть полезно в жизни?
Ну, во-первых, знание химических соединений никогда не может быть лишним. Всегда лучше быть вооружённым знанием, чем остаться без него. Во-вторых, чем больше вы знаете о существовании определённых соединений, тем лучше понимаете механизм их образования и законы, которые позволяют им существовать.
Перед тем как перейти к окончанию, хотелось бы дать несколько рекомендаций по изучению этого материала.
Примечания
- ↑ Косолапова Т. Я.
Карбиды. — Металлургия, 1968. — С. 300. - ↑ Третьяков В. И.
Основы металловедения и технологии производства спечённых твёрдых сплавов. — Металлургия, 1976. — С. 24—268. — 528 с. - Тот Л.
Карбиды и нитриды переходных металлов. — Мир, 1974. — С. 21—23. — 296 с. - Редкол.: Кнунянц И. Л. (гл. ред.).
Химическая энциклопедия: в 5 т. — М.: Советская энциклопедия, 1988. — Т. 1. — С. 420—421. — 623 с. — 100 000 экз. - ↑ Самсонов Г. В.
Физическое материаловедение карбидов. — Наукова думка, 1974. — С. 79—397. — 454 с. - Киффер Р., Бенезовский Ф.
Твердые сплавы. — Металлургия, 1971. — С. 47. — 392 с. - ↑ Самсонов Г. В., Виницкий И. М.
Тугоплавкие соединения (справочник). — Металлургия, 1976. — С. 560. - Лидин Р. А., Молочко В. А., Андреева Л. Л.
Химические свойства неорганических веществ. — Химия, 2000. — С. 330. — 480 с. - Литера H (нем. Hartkern) в обозначении германских боеприпасов ВМВ означает «с твёрдым металлокерамическим сердечником».
- Так 20-мм БПС марки DM43 при стрельбе из пушки MK 20 RH 202 (начальная скорость 1100 м/с) на дальности 1000 м способен пробить 35 мм стальной брони при угле соударения 0°, но лишь 8 мм брони при угле 60°. Jane’s Infantry Weapons 1996—97, 456.
- Дмитрий Сафин.
(недоступная ссылка). Компьюлента (15 октября 2010). — Подготовлено по материалам Wiley. Дата обращения 16 октября 2010.