Понятие о шкале температур
Некоторые неметаллические предметы тоже обладают похожими свойствами. Самым распространённым является вода. Относительно свойств жидкости, занимающей господствующее положение на Земле, была разработана шкала температур. Реперными точками признаны температура изменения агрегатных состояний воды:
- Превращения из жидкости в твердое вещество и наоборот приняты за ноль градусов.
- Кипения (парообразования внутри жидкости) при нормальном атмосферном давлении (760 мм рт. ст.) принята за 100 ⁰С.
Внимание! Кроме шкалы Цельсия на практике измеряют температуру в градусах Фаренгейта и по абсолютной шкале Кельвина. Но при исследовании свойств металлических предметов другие шкалы используют довольно редко.
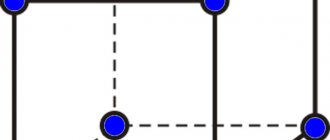
Кристаллические решетки металла
В идеальном виде принято считать, что металлам свойственна кубическая решетка (в реальном веществе могут быть изъяны). Между молекулами имеются равные расстояния по горизонтали и вертикали.
Твердое вещество характеризуется постоянством:
- формы, предмет сохраняет линейные размеры в разных условиях;
- объема, предмет не изменяет занимаемое количество вещества;
- массы, количество вещества, выраженное в граммах (килограммах, тоннах);
- плотности, в единице объема содержится постоянная масса.
При переходе в жидкое состояние, достигнув определенной температуры, кристаллические решетки разрушаются. Теперь нельзя говорить о постоянстве формы. Жидкость будет принимать ту форму, в какую ее зальют.
Когда происходит испарение, то постоянным остается только масса вещества. Газ займет весь объем, который будет ему предоставлен. Здесь нельзя утверждать, что плотность постоянная величина.
Когда соединяются жидкости, то возможны варианты:
- Жидкости полностью растворяются одна в другой, так себя ведут вода и спирт. Во всем объеме концентрация веществ будет одинаковой.
- Жидкости расслаиваются по плотности, соединение происходит только на границе раздела. Только временно можно получать механическую смесь. Перемешав разные по свойствам жидкости. Примером является масло и вода.
Металлы образуют сплавы в жидком состоянии. Чтобы получить сплав, каждый из компонентов должен быть в жидком состоянии. У сплавов возможны явления полного растворения одного в другом. Не исключаются варианты, когда сплав будет получен только в результате интенсивного перемешивания. Качество сплава в этом случае не гарантируется, поэтому стараются не смешивать компоненты, которые не позволяют получать стабильные сплавы.
Образующиеся растворимые друг в друге вещества при застывании образуют кристаллические решетки нового типа. Определяют:
- Гелиоцентрированные кристаллические решетки, их еще называют объёмно-центрированными. В середине находится молекула одного вещества, а вокруг располагаются еще четыре молекулы другого. Принято называть подобные решетки рыхлыми, так как в них связь между молекулами металлов слабее.
- Гранецентрированные кристаллические решетки образуют соединения, в которых молекулы компонента располагаются на гранях. Металловеды называют подобные кристаллические сплавы плотными. В реальности плотность сплава может быть выше, чем у каждого из входящих в состав компонентов (алхимики средних веков искали варианты сплавов, при которых плотность будет соответствовать плотности золота).
Взаимодействие с другими веществами
Каждый неметалл обладает специфическими свойствами, характерными только для него, которые подробно рассматриваются при изучении неорганической химии. Общими свойствами является способность реагировать с металлами, водородом и кислородом.
При взаимодействии с металлами большинство неметаллов выступают окислителями и в образующихся бинарных соединениях проявляют отрицательную степень окисления:
- При реакции активных металлов с водородом образуются твердые нелетучие гидриды. Такие неметаллы как кремний, фосфор и бор вообще неспособны на соединения с водородом.
- Реакции металлов и неметаллов с хлором образуют хлориды. Многие металлы (например, железо) при реакции с хлором начинают гореть, образуя соединения, относящиеся к классу солей. При этом хлорид неметалла никогда не будет солью.
- Взаимодействие с кислородом дает оксиды, которые разделяют на пероксиды и надпероксиды.
- Связь с серой образует сульфиды. При этом для получения формулы сульфида алюминия (Al2S3) вещества нужно нагреть, а для сульфида натрия (Na2S) достаточно простого механического перемешивания.
- Для неметаллов нехарактерно взаимодействие с водой и кислотами.
Неметаллы могут вступать в реакции между собой, при этом более электроотрицательный элемент будет играть роль окислителя, а менее отрицательный станет восстановителем.
Температура плавления металлов
Разные вещества имеют различную температуру плавления. Принято делить металлы на:
- Легкоплавкие – их достаточно нагревать до 600 ⁰С, чтобы получать вещество в жидком виде.
- Среднеплавкие металлы расплавляются в диапазоне температур 600…1600 ⁰С.
- Тугоплавкими называют металлы, которые могут расплавляться при температуре более 1600 ⁰С.
В таблице по возрастанию показаны легкоплавкие металлы. Здесь видно, что самым необычным металлом является ртуть (Hg). В обычных условиях она находится в жидком состоянии. Этот металл имеет самую низкую температуру плавления.
Таблица 1, температуры плавления и кипения легкоплавких металлов:
Таблица 2, температуры плавления и кипения среднеплавких металлов:
Таблица 3, температуры плавления и кипения тугоплавких металлов:
Чтобы вести процесс плавки используют разные устройства. Например, для выплавки чугуна применяют доменные печи. Для плавки цветных металлов производят внутренний нагрев с помощью токов высокой частоты.
В изложницах, изготовленных из неметаллических материалов, находятся цветные металлы в твердом состоянии. Вокруг них создают переменное магнитное поле СВЧ. В результате кристаллические решетки начинают расшатываться. Молекулы вещества приходят в движение, что вызывает разогрев внутри всей массы.
При необходимости плавки небольшого количества легкоплавких металлов используют муфельные печи. В них температура поднимается до 1000…1200 ⁰С, что достаточно для плавки цветных металлов.
Черные металлы расплавляют в конвекторах, мартенах и индукционных печах. Процесс идет с добавлением легирующих компонентов, улучшающих качество металла.
Сложнее всего проводить работу с тугоплавкими металлами. Проблема в том, что нужно использовать материалы, имеющие температуру более высокую, чем температура плавления самого металла. В настоящее время авиационная промышленность рассматривает использование в качестве конструкционного материала Титан (Ti). При высокой скорости полета в атмосфере происходит разогрев обшивки. Поэтому нужна замена алюминию и его сплавам (AL).
Максимальная температура плавления этого довольного легкого металла привлекает конструкторов. Поэтому технологи разрабатывают технологические процессы и оборудование, чтобы производить детали из титана и его сплавов.
Галогены
Элементы, расположенные в главной подгруппе седьмой группы таблицы периодической системы, являются в химическом отношении самыми активными неметаллами. Их атомы имеют одинаковое количество электронов -7 на последнем энергетическом уровне, что и объясняет схожесть их химических характеристик.
Физические свойства простых веществ – неметаллов различны. Так, фтор, хлор находятся в газообразной фазе, жидкостью является бром, а твердое состояние присуще йоду. Активность галогенов в группе с увеличением заряда ядра атома ослабевает, фтор является самым реакционно способным среди галогенов. В реакционной способности ему ступает лишь кислород, входящий в группу халькогенов. Сила водородных соединений галогенов, водные растворы которых являются кислотами, от фтора до йода возрастает, а растворимость малорастворимых солей уменьшается. Особое положение фтора среди галогенов касается и его способности к реакциям с водой. Галоген может разлагать воду, образуя различные продукты: собственный оксид F2O, озон, кислород и перекись водорода.
Сплавы металлов
Чтобы проектировать изделия из сплавов, сначала изучают их свойства. Для изучения в небольших емкостях расплавляют изучаемые металлы в разном соотношении между собой. По итогам строят графики.
Нижняя ось представляет концентрацию компонента А с компонентом В. По вертикали рассматривают температуру. Здесь отмечают значения максимальной температуры, когда весь металл находится в расплавленном состоянии.
При охлаждении один из компонентов начинает образовывать кристаллы. В жидком состоянии находится эвтектика – идеальное соединение металлов в сплаве.
Металловеды выделяют особое соотношение компонентов, при котором температура плавления минимальная. Когда составляют сплавы, то стараются подбирать количество используемых веществ, чтобы получать именно эвтектоидный сплав. Его механические свойства наилучшие из возможных. Кристаллические решетки образуют идеальные гранецентрированные положения атомов.
Изучают процесс кристаллизации путем исследования твердения образцов при охлаждении. Строят специальные графики, где наблюдают, как изменяется скорость охлаждения. Для разных сплавов имеются готовые диаграммы. Отмечая точки начала и конца кристаллизации, определяют состав сплава.
Место неметаллов в системе химических элементов
Изменение свойств атомов неметаллических элементов происходит с увеличением порядкового номера. В периоде благодаря увеличению заряда ядра происходит сжатие атома и уменьшение его радиуса. Также усиливается окислительная способность, а восстановительные свойства элементов ослабевают. Физические свойства неметаллов, а также особенности их взаимодействия с другими веществами зависят от строения их внешнего энергетического уровня. От него же зависит и способность атомов притягивать в сферу своего влияния чужие электроны. Например, во втором периоде от бора до фтора электроотрицательность неметаллов увеличивается. Самым активным среди всех неметаллических элементов является фтор. В своих соединениях он сильнее всех удерживает чужие электроны, сохраняя заряд -1.
Сплав Вуда
В 1860 г. американский зубной техник Барнабас Вуд искал оптимальные соотношения компонентов, чтобы изготавливать зубы для клиентов при минимальных температурах плавления. Им был найден сплав, который имеет температуру плавления всего 60,2…68,5 ⁰С. Даже в горячей воде металл легко расплавляется. В него входят:
- олово — 12,5…12,7 %;
- свинец — 24,5…25,0 %;
- висмут — 49,5…50,3 %;
- кадмий — 12,5…12,7 %.
Сплав интересен своей низкой температурой, но практического применения так и не нашел. Внимание! Кадмий и свинец – это тяжелые металлы, контакт с ними не рекомендован. У многих людей могут происходить отравления при контакте с кадмием.
Сплавы для пайки
На практике многие сталкиваются с плавлением при пайке деталей. Если поверхности соединяемых материалов очищены от загрязнений и окислов, то их нетрудно спаять припоями. Принято делить припои на твердые и мягкие. Мягкие получили наибольшее распространение:
- ПОС-15 — 278…282 °C;
- ПОС-25 — 258…262 °C;
- ПОС-33 — 245…249 °C;
- ПОС-40 — 236…241 °C;
- ПОС-61 — 181…185 °C;
- ПОС-90 — 217…222 °C.
Их выпускают для предприятий, изготавливающих разные радиотехнические приборы.
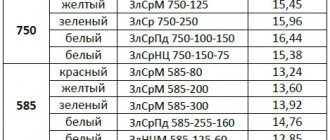
Твердые припои на основе цинка, меди, серебра и висмута имеют более высокую температуру плавления:
- ПСр-10 — 825…835 °С;
- ПСр-12 — 780…790 °С;
- ПСр-25 — 760…770 °С;
- ПСр-45 — 715…721 °С;
- ПСр-65 — 738…743 °С;
- ПСр-70 — 778…783 °С;
- ПМЦ-36 — 823…828 °С;
- ПМЦ-42 — 830…837 °С;
- ПМЦ-51 — 867…884 °С.
Использование твердых припоев позволяет получать прочные соединения.
Внимание! Ср означает, что в составе припоя использовано серебро. Такие сплавы обладают минимальным электрическим сопротивлением.
Температура плавления неметаллов
Неметаллические материалы могут быть представлены в твердом и жидком виде. Неорганические вещества представлены в табл. 4.
Таблица 4, температура плавления неорганических неметаллов:
На практике для пользователей наибольший интерес представляют органические материалы: полиэтилен, полипропилен, воск, парафин и другие. Температура плавления некоторых веществ показана в табл. 5.
Таблица 5, температура плавления полимерных материалов:
Внимание! Под температурой стеклования понимают состояние, когда материал становится хрупким.
Видео: температура плавления известных металлов.
Кислород и его особенности
Элемент является самым распространенным на Земле. Его содержание в почве составляет более 47%, а масса газа в воздухе равна 23,15%. Общие физические свойства неметаллов, таких как азот, кислород, водород, находящихся в газообразном состоянии, определяются строением их молекул.
Все они состоят из двух атомов, связанных ковалентными неполярными связями. В атоме кислорода на последнем энергетическом уровне находятся два свободных p-электрона. Поэтому степень окисления элемента обычно равна -2, а в соединениях со фтором (например, OF2) +2. Кислород плохо растворим в воде, при температуре -183 ⁰C он превращается в легко подвижную жидкость голубого цвета, способную притягиваться магнитом. Элемент представлен двумя простыми веществами: кислородом O2 и озоном O3. Характерный запах озона можно ощутить в воздухе после грозового дождя. Вещество чрезвычайно агрессивно, разлагает органические материалы и окисляет даже пассивные металлы, такие как платина или золото. Большинство сложных веществ — оксидов, солей, оснований и кислот — содержат в составе своих молекул атомы кислорода.